
| A、甲、乙两溶液均呈酸性 |
| B、甲、乙两溶液中c(H+)之比为1:2 |
| C、甲、乙两溶液中水的电离程度大小无法比较 |
| D、甲中水的电离程度小于乙中水的电离程度 |


 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
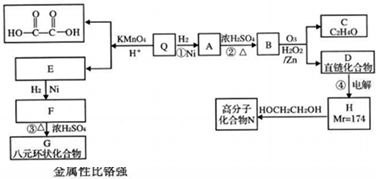
| KMnO4/H+ |
| O3 |
| H2O2/Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4 |
| B、HCl |
| C、NaOH |
| D、NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由H2、I2(g)、HI组成的平衡体系,加压(缩体积)后颜色加深 |
| B、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| C、实验室中常用排饱和食盐水的方法收集氯气 |
| D、合成氨中增加N2的物质的量浓度可提高H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定温度和压强下,各种气态物质体积大小由分子间距离决定 |
| B、相同温度时,CO2和N2O若体积相同,则它们的质量一定相同 |
| C、100g浓度为18mol/L的浓硫酸中加入等质量的水稀释浓度大于9mol/L |
| D、14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40% |
查看答案和解析>>
科目:高中化学 来源: 题型:
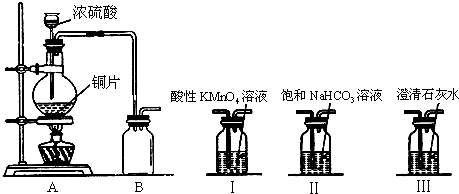
 二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图:
二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用酸式滴定管量取25.00mL溴水 |
| B、不宜用瓷坩埚熔融氢氧化钠或碳酸钠 |
| C、测定溶液的pH时用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较 |
| D、圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com