
工业制备氯化铜时,将浓盐酸用蒸气加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6,将Fe2+沉淀除去?________,理由是_______________________________________________。
有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是____。(填序号)
A.一定增大 B.一定减小C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?________,理由是__________________。
现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有________(有几个选几个填代号)。
A.浓HNO3 B.KMnO4 C.Cl2 D.O2 E.H2O2
(2)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有________(多选不限,填代号)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3 E.CuO F.Cu(OH)2
(1)不能 因Fe2+沉淀的pH最大,Fe2+沉淀完全时Cu2+亦沉淀完全 ①A ②不妥当 引入新杂质Na+ CDE (2)CEF
【解析】由题意可知:Fe2+沉淀的pH≥9.6,如果直接调整pH=9.6,Cu2+、Fe3+先于Fe2+沉淀(这两种离子沉淀的pH均比Fe2+沉淀的pH小),得不到CuCl2,故不能直接调整pH=9.6,可将Fe2+氧化成Fe3+。NaClO在酸性条件下与Fe2+的反应是:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,由于反应过程中要消耗H+,溶液pH一定升高。NaClO可以将Fe2+氧化成Fe3+,但引入了新杂质Na+,实际上不能采用。必须应用既能氧化Fe2+又不能引入新杂质的氧化剂,例如Cl2、O2、H2O2等,同理,调整pH所选用的试剂可以是CuO、Cu2(OH)2CO3、Cu(OH)2等不会引入新杂质的物质。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014年高考化学苏教版一轮复习专练1 化学实验仪器的创新使用练习卷(解析版) 题型:选择题
按图装置通入X气体,并在管P处点燃,实验结果是澄清石灰水变浑浊,则X、Y可能是 ( )。
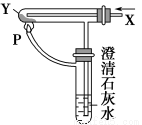
A.H2和Fe2O3
B.CO和CuO
C.H2和Na2CO3
D.CO和Na2CO3
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.钢铁发生电化学腐蚀的负极反应式:Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
下列事实不能说明一元酸HA为弱酸的是( )
A.常温下0.1 mol·L-1的HA溶液pH为5
B.常温下NaA溶液的pH>7
C.HA溶液中存在H+、OH-、A-、HA
D.HA溶液能与大理石反应
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
下列有关金属腐蚀与防护的说法正确的是( )
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接银块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:填空题
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对稀释后醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________和________。
(2)为标定某醋酸溶液的准确浓度,用0.2000 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.50 | 19.95 |
则该醋酸溶液的准确浓度为__________(保留小数点后四位)。
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25°C时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
____________________________________________________
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度________(填“增大”、“减小”或“不变”)。
(5)实验三:该同学用pH计测定相同浓度的醋酸在几种不同温度时的pH,该同学的实验目的是:____________________________________________
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.25℃时 NH4Cl 溶液的 KW 大于 100℃ 时 NaCl 溶液的 KW
B.SO2 通入碘水中,反应的离子方程式为 SO2+I2+2H2O=SO +2I-+4H+
+2I-+4H+
C.加入铝粉能产生 H2 的溶液中,可能存在大量的 Na+、Ba2+、AlO 、NO
、NO
D.100℃时,将 pH =2 的盐酸与 pH =12 的 NaOH 溶液等体积混合,溶液显中性
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:选择题
可逆反应mA(g)+nB pC(g)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是( )
pC(g)+qD(其中A和C都是无色气体),当达到平衡时,下列叙述正确的是( )
A.增大压强,平衡不移动,说明(m+n)一定等于(p+q)
B.升高温度,A的转化率减小,说明正反应是吸热反应
C.若增加B的量,平衡体系颜色加深,说明B必是气体物质
D.若B是气体,增加A的量,A、B转化率都一定增大
查看答案和解析>>
科目:高中化学 来源:2014年高中化学人教版选修四第四章 电化学基础练习卷(解析版) 题型:填空题
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-―→2O2-)。
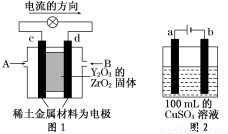
(1)c电极的名称为 ,d电极上的电极反应式为 。
(2)如图2所示用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为 ,若a电极产生56 mL(标准状况)气体,则所得溶液的pH= (不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入 (填序号)。
a.CuO b.Cu(OH)2
c.CuCO3 d.Cu2(OH)2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com