
| A. | KCl>NaCl>BaO>CaO | B. | NaCl>KCl>CaO>BaO | ||
| C. | CaO>BaO>KCl>NaCl | D. | CaO>BaO>NaCl>KCl |
分析 在离子晶体中,离子的半径越小,晶格能越大;阴、阳离子所带电荷越多,晶格能越大,则晶体的熔点越高;电荷的影响大于半径的影响,据此判断.
解答 解:KCl、NaCl、CaO、BaO均为离子化合物,
KCl、NaCl阴离子相同,电荷数相同,阳离子的半径越小,晶格能越大,熔点越高,阳离子半径K+>Na+,则熔点NaCl>KCl,
BaO、CaO阴离子相同,电荷数相同,阳离子的半径越小,晶格能越大,熔点越高,阳离子半径Ca2+>Ba2+,则熔点CaO>BaO,
阴、阳离子所带电荷越多,晶体的熔点越高;而且电荷的影响大于半径的影响,
所以四种化合物熔点的高低顺序为CaO>BaO>NaCl>KCl,
故选D.
点评 本题考查离子晶体的熔沸点的判断,难度不大,注意离子化合物形成的离子晶体中,离子键的键长越短,阴、阳离子所带电荷越多,则晶体的熔点越高.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 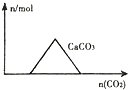 向Ca(OH)2和NaOH的混合溶液中通入CO2 | |
| B. | 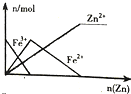 向FeCl3溶液中加入锌粉 | |
| C. |  向NaOH溶液中通入CO2 | |
| D. |  HCl与Cl2的混合通入NaOH溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L戊烷中存在的共价键总数为1.6NA | |
| B. | 23gNO2与N2O4的混合气体中含有的氮原子数为0.5NA | |
| C. | 过氧化钠与二氧化碳反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 1L0.1mol•L-1的NaH2PO4溶液中H2PO4-、HPO42-和PO43-离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键可以使离子相结合,也可以使原子相结合 | |
| B. | 非金属元素的原子之间只能形成共价键 | |
| C. | 化学反应过程中,反应物分子内的化学键断裂,产物分子中化学键形成 | |
| D. | 化学键是一种作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同物质的量浓度的Na2Y和NaHY溶液,前者的pH大于后者 | |
| B. | NaHY的溶液中,离子浓度大小顺序为:c(Na+)>c(Y-)>c(HY-)>c(OH-)>c(H+) | |
| C. | HY-的水解离子方程式为:HY-+H2O?Y-+H3O+ | |
| D. | 在Na2Y、NaHY、H2Y的溶液中,阴离子的种类不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
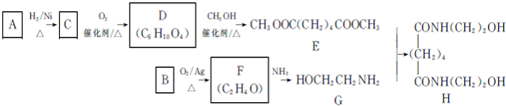
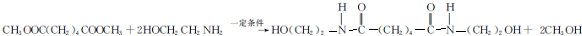 .
.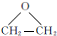 ,能发生银镜反应的F的同分异构体是CH3CHO.
,能发生银镜反应的F的同分异构体是CH3CHO.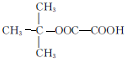 (写结构简式).
(写结构简式).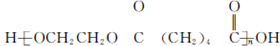 的合成路线:
的合成路线: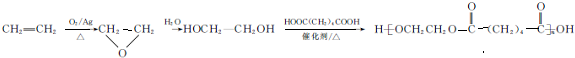 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最易失去的电子能量最高 | |
| B. | 电离能最小的电子能量最高 | |
| C. | 2p轨道电子能量高于2s轨道电子能量 | |
| D. | 在离核最近区域内运动的电子能量最高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com