
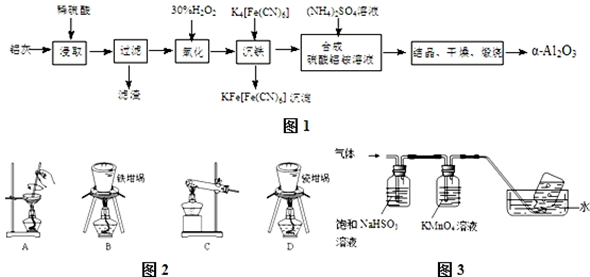
分析 铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3)加稀硫酸,Al2O3、FeO、Fe2O3转化为离子,SiO2不溶于硫酸,过滤,滤液中含有Al3+、Fe2+、Fe3+,加双氧水,Fe2+被氧化为Fe3+,加入K4[Fe(CN)6]Fe3+转化为沉淀,过滤,在滤液中加入硫酸铵,生成NH4Al(SO4)2,结晶、干燥、煅烧得到α-Al2O3;
(1)Al2O3与硫酸反应生成硫酸铝和水;
(2)蒸发皿不能用来加热固体,瓷坩埚含有二氧化硅和氢氧化钠反应;
(3)加30%的H2O2溶液Fe2+被氧化为Fe3+;
(4)三价铁离子遇到K4[Fe(CN)6]反应生成沉淀,据此设计实验检验是否含铁离子;
(5)依据平衡常数的概念结合反应写出计算式计算平衡浓度解答;
(6)①NH4Al(SO4)2•12H2O分解生成的气体NH3和SO3被亚硫酸钠吸收,二氧化硫被高锰酸钾吸收;
②KMnO4与二氧化硫反应生成硫酸根离子和锰离子.
解答 解:铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3)加稀硫酸,Al2O3、FeO、Fe2O3转化为离子,SiO2不溶于硫酸,过滤,滤液中含有Al3+、Fe2+、Fe3+,加双氧水,Fe2+被氧化为Fe3+,加入K4[Fe(CN)6]Fe3+转化为沉淀,过滤,在滤液中加入硫酸铵,生成NH4Al(SO4)2,结晶、干燥、煅烧得到α-Al2O3;
(1)Al2O3与硫酸反应生成硫酸铝和水,其反应的方程式为:Al2O3+3H2SO4=Al2(SO4)3+3H2O;
故答案为:Al2O3+3H2SO4=Al2(SO4)3+3H2O;
(2)A.蒸发皿不能用来加热固体,故A不符合;
B.铁坩埚可以熔融二氧化硅和氢氧化钠,故B符合;
C.玻璃中含二氧化硅和氢氧化钠反应,故C不符合;
D.瓷坩埚含有二氧化硅和氢氧化钠反应,故D不符合;
故答案为:B;
(3)滤液中含有Al3+、Fe2+、Fe3+,加30%的H2O2溶液Fe2+被氧化为Fe3+,其反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)铁离子和铁氰化钾反应产生沉淀,其检验方法是:静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有,
故答案为:静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有;
(5)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38,c(H+)=$\frac{1{0}^{-14}}{c(O{H}^{-})}$,反应Fe3++3H2O?Fe(OH)3+3H+的平衡常数K=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$=$\frac{1{0}^{-42}}{c(F{e}^{3+}){c}^{3}(O{H}^{-})}$=2.5×10-5,故答案为:2.5×10-5;
(6)①NH4Al(SO4)2•12H2O分解生成的气体NH3和SO3被亚硫酸钠吸收,二氧化硫被高锰酸钾吸收,所以最后集气瓶中收集到的气体是N2;
故答案为:N2;
②酸性条件下,KMnO4与二氧化硫反应生成硫酸根离子和锰离子,其反应的离子方程式为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;
故答案为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.
点评 本题以氧化铝提取工艺流程为载体,考查元素化合物性质及相互转化、氧化还原、离子方程式、实验基本操作等知识点,注意把握制备原理,把握物质的性质以及相关反应方程式的书写,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 门捷列夫利用软锰矿和浓盐酸反应制得了氯气 | |
| B. | 利用火力发电厂及核电站用于冷却的循环海水来提取单质溴以减少能耗 | |
| C. | 含重金属离子的污水的排放产生“赤潮”或“水华”等水污染现象 | |
| D. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .
. )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g CH4所含原子数目为NA | |
| B. | 1mol•L-1 NaCl溶液含有NA个Na+ | |
| C. | 常温常压下,22.4L CO2中含有NA个CO2分子 | |
| D. | 2.4g Mg与足量盐酸反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com