
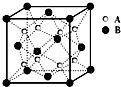
 某晶体中晶体结构最小的重复单元如图:A在正方体内,B分别在顶点和面心,则该晶体的化学式为( )
某晶体中晶体结构最小的重复单元如图:A在正方体内,B分别在顶点和面心,则该晶体的化学式为( )| A. | B2A | B. | BA2 | C. | B7A4 | D. | B4A7 |
科目:高中化学 来源: 题型:选择题
| A. | 铝与氢氧化钠溶液反应生成67.2LH2时,转移的电子数为9NA | |
| B. | 2L0.5mol/L醋酸钠溶液中含CH3COO-个数小于NA | |
| C. | 28gCO和C2H4的混合气体中含有的碳原子总数为1.5NA | |
| D. | 2molSO2与2molO2在密闭容器中充分反应后,容器内的气体分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
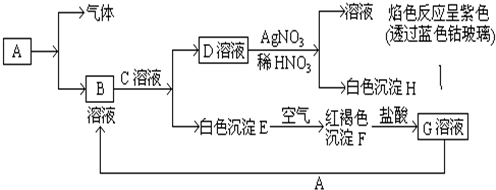
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水煤气 | B. | 焦炉煤气 | C. | 石油液化气 | D. | 高炉煤气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硝酸锌溶液代替硫酸锌溶液进行实验,能观察到同样的现象 | |
| B. | 沉淀溶解后,将生成配合离子[Zn(NH3)4]2+ | |
| C. | 反应后溶液中不存在任何沉淀,所以反应前后Zn2+的浓度不变 | |
| D. | 在[Zn(NH3)4]2+离子中,NH3给出孤对电子,Zn2+提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁比纯铁更易锈蚀 | |
| B. | 构成原电池的正极和负极必须是两种不同的金属 | |
| C. | 纯银器在空气中表面渐渐变暗是因为发生了原电池反应 | |
| D. | 充电电池的充放电次数有限是由它的工作原理所决定的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
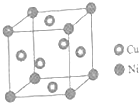 东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
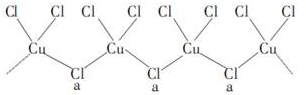
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把钠投入水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2═I2+2H2O | |
| C. | 碳酸氢钠与稀硫酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com