
【题目】现有7种物质:①干冰②金刚石③四氢化碳④晶体硅⑤过氧化钠⑥二氧化硅晶体⑦氯化铵(用序号回答)
(1)这些物质中熔点最高的是
(2)属于分子晶体的是 , 其中分子构型为正四面体的是 , 杂化类型为 .
(3)属于离子晶体的是
(4)写出含有极性键和配位键的离子化合物的电子式 .
【答案】
(1)②
(2)①③;③;sp3
(3)⑤⑦
(4)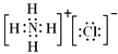
【解析】解:(1)干冰、四氢化碳常温下为气体,其晶体为分子晶体;氯过氧化钠、氯化铵为离子晶体;金刚石、二氧化硅晶体、晶体硅为原子晶体,金刚石是由C﹣C键形成,二氧化硅由Si﹣O键形成,硅单质由Si﹣Si键形成,其中C﹣C键键长最短,键能最大,所以熔点最高的是金刚石,所以答案是:②;(2)干冰、四氢化碳都是由分子构成的分子晶体,其中干冰为直线型分子,四氢化碳中心原子C电子对数为 ![]() =4,杂化方式为sp3 , 孤电子对数为0,分子构型为正四面体,所以答案是:①③;③;sp3;(3)过氧化钠、氯化铵都是由离子构成的离子晶体,所以答案是:⑤⑦;(4)NH4Cl中阴阳离子之间形成离子键,铵根离子中含有极性键和配位键;所以既含有离子键,又含有极性键和配位键的离子晶体是NH4Cl,其电子式为
=4,杂化方式为sp3 , 孤电子对数为0,分子构型为正四面体,所以答案是:①③;③;sp3;(3)过氧化钠、氯化铵都是由离子构成的离子晶体,所以答案是:⑤⑦;(4)NH4Cl中阴阳离子之间形成离子键,铵根离子中含有极性键和配位键;所以既含有离子键,又含有极性键和配位键的离子晶体是NH4Cl,其电子式为 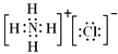 ,所以答案是:
,所以答案是: 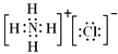 .
.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】席夫碱类化合物G在催化、药物、新材料等方面有广泛应用.合成G的一种路线如下: 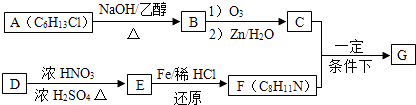
已知以下信息:
① ![]()
②1molB经上述反应可生成2molC,且C不能发生银镜反应.
③D属于单取代基芳烃,其相对分子质量为106
④F苯环上的一氯代物有2种
⑤ ![]()
回答下列问题
(1)由A生成B的反应类型为 , B中官能团的电子式为 .
(2)C的结构简式为 , D的一氯代物共有种.
(3)写出下列反应的化学方程式: E→F:
C+F→G:
(4)由苯和化合物C经如下步骤可合成N﹣异丙基苯胺. ![]()
反应条件1所选择的试剂为;反应条件2所选择的试剂为;I的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 第二周期元素从C到F,非金属性逐渐增强
B. 第三周期元素从Na到Cl,原子半径逐渐增大
C. HF、HCl、HBr、HI的热稳定性依次逐渐增强
D. LiOH、NaOH、KOH的碱性依次逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等体积的NH3和CH4两种气体,下列有关说法错误的是( )
A. 所含分子数相同 B. 所含氢原子物质的量之比为3:4
C. 质量之比为16:17 D. 密度之比为17:16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.常温常压下,20gH218O中含有中子数目为12NA
B.标准状况下,11.2LC2H6中含有极性键的数目为3.5NA
C.1LpH=3的CH3COOH溶液中,含有H+的数目大于10﹣3NA
D.1L1molL﹣1稀硝酸(还原产物为NO)与铁完全反应,转移电子数目为0.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20.其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1 . B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半.请回答下列问题:
(1)A是 , B是 , C是 , D是 , E是(填写元素符号).
(2)B与D的氢化物中沸点较高的是(填化学式),理由 .
(3)元素B与D的电负性的大小关系是 , C与E的第一电离能的大小关系是(均填元素符号,填“>”、“<”或“=”).
(4)如何检验E元素 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com