
| KW |
| c(OH-) |
| 1.6��10-13 |
| 5.0��10-6 |
| 0.02mol |
| 0.2L |
| 10-14 |
| 0.1 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| NaOH��Һ��ʼ���� | NaOH��Һ�յ���� | ������� | |
| ��һ�� | 0.10mL | 18.60mL | 20.00mL |
| �ڶ��� | 0.40mL | 19.00mL | 20.00mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ��ʾCl2ͨ��SO2��Һ��pH�ı仯 |
B��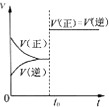 ��ʾ�Ѵ�ƽ���ij���淴Ӧ����t0ʱ�ı�ijһ������Ӧ������ʱ��仯����ı������һ���Ǽ������ |
C�� ��ʾ�ں������ʵ���NaOH��Na2CO3�Ļ����Һ�еμ�0.1mol?L-1����������ʱ������������������������Ĺ�ϵ |
D�� ��ʾ10 mL 0.01 mol?L-1KMnO4 ������Һ�������0.1 mol?L-1 H2C2O4��Һ���ʱ��n��Mn2+�� ��ʱ��ı仯��Mn2+�Ը÷�Ӧ�д����ã� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1L 0.1mol/L��NH4��2Fe��SO4��2����Һ��c��SO42-����c��NH4+����c��Fe2+����c��OH-����c��H+�� |
| B����Na2CO3��NaHCO3�Ļ����Һ�У�c��Na+��+c��H+��=c��HCO3-��+c��OH-��+c��CO32-�� |
| C�������£�CH3COONa��Һ������������������Һ��c��Na+����c��Cl-��=c��CH3COOH�� |
| D��25��ʱ��pH=4.5��NaHC2O4��Һ��c��HC2O4-����c��C2O42-����c��H2C2O4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Kw |
| B��c��H+��/Ka |
| C��c��HA��/c��A-�� |
| D��c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
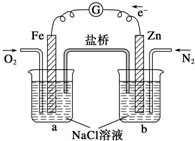
| A���ձ�a�е���ҺpH���� |
| B���ձ�b�з���������Ӧ |
| C���ձ�a�з����ķ�ӦΪ2H++2e-�TH2 |
| D���ձ�b�з����ķ�ӦΪ2Cl--2e-�TCl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com