
| A. | CH4>SiH4>GeH4>SnH4 | B. | KCl>NaCl>MgCl2>MgO | ||
| C. | Rb>K>Na>Li | D. | 金刚石>SiC>Si>S |
分析 不同晶体的熔点:一般为原子晶体>离子晶体>金属晶体>分子晶体;相同晶体从影响晶体熔沸点高低的因素分析.
解答 解:A.分子结构相似,且都为分子晶体,分子的相对分子质量越大,分子之间作用力越大,熔点越高,则有CH4<SiH4<GeH4,故A错误;
B.离子晶体的晶格能大小取决于离子半径的电荷的因素,离子半径越小,电荷越多,晶格能越大,离子晶体的熔点越高,则有KCl<NaCl<MgCl2<MgO,故B错误;
C.碱金属从上到下,原子半径逐渐增大,金属键键能逐渐减小,金属晶体的熔点逐渐降低,则有Rb<K<Na<Li,故C错误;
D.金刚石、SiC、Si均为原子晶体,键长C-C<C-Si<Si-Si,则熔点为金刚石>SiC>Si,S为分子晶体,熔点最低,故D正确.
故选D.
点评 本题考查晶体熔点的比较,为高频考点,注意把握影响不同晶体熔沸点高低的因素,学习中注重相关基础知识的积累,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKap | 37.4 | 19.3 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| B | 向某溶液中加入新制Cu(OH)2,加热出现红色沉淀 | 证明溶液中一定含醛类物质 |
| C | 取2mL 溴乙烷,加入适量NaOH水溶液,加热.一段时间后,向溶液中滴加AgNO3溶液,有淡黄色沉淀产生 | 溴乙烷中的Br变成了Br- |
| D | 取2mL 溴乙烷,加入适量NaOH乙醇溶液,加热.将产生的气体通入Br2的四氯化碳溶液中,溶液褪色 | 反应生成乙烯,溴乙烷与NaOH乙醇溶液发生消去反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 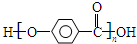 的结构中含有酯基 的结构中含有酯基 | |
| B. | 甲基的电子式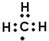 | |
| C. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| D. | 用重结晶的方法提纯苯甲酸时应趁热过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯水振荡,观察水层是否有红棕色出现 | |
| B. | 滴入AgNO3溶液,再加入稀HNO3,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,然后加入稀HNO3使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2. ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com