
| A. | 标准状况下,22.4LH2O含有的分子数为1NA | |
| B. | 5.6g铁与足量氯气反应,转移的电子数目为0.3NA | |
| C. | 常温常压下,NA个CO2和CO分子占有的体积约为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
分析 A、标况下水为液态;
B、求出铁的物质的量,然后根据反应后铁元素变为+3价来分析;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、溶液体积不明确.
解答 解:A、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、5.6g铁的物质的量为0.1mol,而反应后铁元素变为+3价,故0.1mol铁转移0.3mol电子即0.3NA个,故B正确;
C、NA个CO2和CO分子的物质的量为1mol,而常温常压下,气体摩尔体积大于22.4L/mol,故所占的体积大于22.4L,故C错误;
D、溶液体积不明确,故溶液中的氯离子的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 向氨水中滴入盐酸:H++OH-=H2O | |
| B. | 向澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O | |
| C. | 稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 钠跟水反应:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质碳具有还原性 | |
| B. | 木炭燃烧时吸收大量的热 | |
| C. | 用活性炭可除去硬水中的氯化钙杂质 | |
| D. | 金刚石、石墨都是由碳原子构成的,都很硬 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加盐酸有无色气体产生,该气体能使澄清石灰水变混浊,原溶液中一定有CO32- | |
| B. | 加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有SO42- | |
| C. | 某溶液中加入Na2CO3溶液后有白色沉淀,则该溶液中一定有Ca2+ | |
| D. | 某溶液的焰色反应为黄色,则该溶液中一定有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+ | |
| B. | 一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+ | |
| C. | c(Clˉ)为 4.00mol•L-1,c(Al3+)为1.00 mol•L-1 | |
| D. | c(Mg2+)为 1.00mol•L-1,c(Na+)为 0.50 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漏斗、玻璃棒、烧杯、铁架台、滤纸 | B. | 烧杯、酒精灯、试管、漏斗 | ||
| C. | 滤纸、烧杯、试管夹、漏斗、玻璃棒 | D. | 玻璃棒、滤纸、烧瓶、漏斗、铁架台 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将适量CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol•L-1 | |
| B. | 在25℃时,将c mol•L-1的醋酸溶液与0.02 mol•L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{2×1{0}^{-9}}{c-0.02}$ | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:N前<N后 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 0℃ | 50℃ | 80℃ | |
| Ca(OH)2 | 0.173g | 0.13g | 0.094g |
| Ba(OH)2•8H2O | 1.64g | 13.2g | 101.4g |
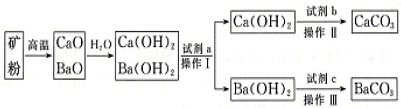
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com