
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | 足球烯(C60)在苯中的溶解度大 | 足球烯是原子晶体 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氮原子2p能级半充满,所以比较稳定,难以失去电子;
B.足球烯为非极性分子,易溶于非极性溶剂苯,而足球烯为分子晶体;
C、金刚石是原子晶体;
D、从HF分子中含有氢键角度分析.
解答 解:A.氮原子2p能级半充满,所以比较稳定,氮原子的第一电离能大于氧原子,故A正确;
B.足球烯为分子晶体,足球烯(C60)在苯中的溶解度大,主要原因是非极性分子易溶于非极性溶剂,故B错误;
C.金刚石是原子晶体,石墨为混合晶体,故C错误;
D.理论解释不对,HF分子中含有氢键,故HF的沸点高于HCl,故D错误.
故选A.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及第一电离能、晶体类型、沸点大小比较等知识,明确晶体类型与性质为解答关键,试题培养了学生的分析能力及灵活应用能力.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
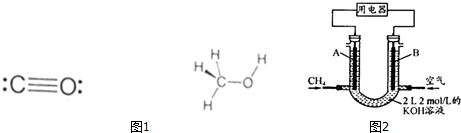
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将米饭在嘴中多加咀嚼就会变甜 | |
| B. | 羊毛和棉花的主要成分都是纤维素 | |
| C. | 为提高加酶洗衣粉的去污能力,应使用热水进行洗涤 | |
| D. | 未成熟的苹果遇碘水会变蓝,是因为其中含有淀粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验室可用Na2SO3与浓H2SO4反应制备SO2 | |
| B. | 用澄清石灰水可鉴别CO2和SO2 | |
| C. | Na2SO3长期放置空气中容易变质 | |
| D. | SO2通入BaCl2溶液中能产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 四种元素的原子半径:Z<Y<X<W | |
| B. | 化合物Z2Y与ZW中的化学键类型相同 | |
| C. | X与W两种元素的最简单氢化物间能发生化合反应 | |
| D. | 常温下,X和Y形成的所有化合物均为无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .请根据图回答:
.请根据图回答:
 .
. ; ②CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O.
; ②CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C14H18O5 | B. | C14H22O3 | C. | C14H22O5 | D. | C14H10O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
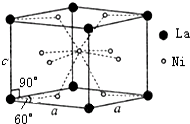 材料的开发、应用和发展是科技进步的结果,同时,材料的发展也促进了科技的进步和发展.
材料的开发、应用和发展是科技进步的结果,同时,材料的发展也促进了科技的进步和发展.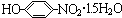 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com