
【题目】下列过程中不涉及化学变化的是
A.粮食酿酒 B.用食醋除去水壶中的水垢
C.用木炭除去冰箱中的异味 D.苹果腐烂
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)![]() 2HF(g);△H= -270kJ/mol,下列说法正确的是
2HF(g);△H= -270kJ/mol,下列说法正确的是
A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的的是( )
A.检验NH![]() 时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
B.向做完蔗糖水解后的溶液中直接加入新制的Cu(OH)2并加热,以检验蔗糖是否水解
C.将混有HCl的CO2通入饱和Na2CO3溶液中除去HCl
D.将Al2(SO4)3溶液蒸干制备Al2(SO4)3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体。
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。利用下图所示装置进行实验。
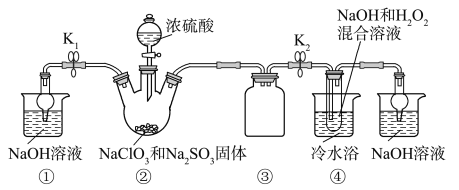
(1)装置①的作用是_______________,装置③的作用是______________________。
(2)装置②中产生ClO2气体的化学方程式为________________________。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55 ℃蒸发结晶;
②趁热过滤;
③________________________;
④低于60 ℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。设计如下实验方案,并进行实验。
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO![]() +4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
+4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。
)。
(4)样品中NaClO2的质量分数为__________(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示。
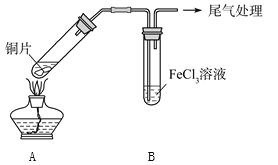
(1)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色,然后开始实验。
步骤① | 配制1 mol·L-1FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A |
FeCl3溶液显酸性的原因是__________________。写出装置A中产生SO2的化学方程式:_______________________________。
(2)当SO2通入FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。
【查阅资料】[Fe(HSO3)]2+为红棕色,它可以将Fe3+还原为Fe2+。生成
[Fe(HSO3)]2+的反应为可逆反应。
解释SO2与FeCl3溶液反应生成红棕色[Fe(HSO3)]2+的原因:_________________________。
写出溶液中[Fe(HSO3)]2+与Fe3+反应的离子方程式: ________________________。
(3)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了步骤②、③的实验。
步骤② | 往5 mL 1 mol·L-1FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色 |
步骤③ | 往5 mL重新配制的1 mol·L-1FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色 |
用铁氰化钾溶液检验步骤②和步骤③所得溶液中的Fe2+,其现象为____________________。
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物[Fe(HSO3)]2+;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质资源是一种污染小的可再生能源,生物质的主要转化途径及主要产物如图。
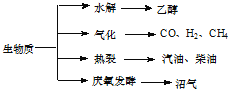
(1)下列有关说法正确的是
A.生物质能,本质上能量来源于太阳能
B.由纤维素水解获得的乙醇属生物质能
C.生物质裂解获得的汽油、柴油等属于纯净物
D.由植物秸秆等发酵获得的沼气,主要成分是甲烷
(2) 由生物质能获得的CO和H2,当两者1: 1催化反应,其原子利用率达100%,合成的物质可能是________。
A.汽油 B.甲醇 C.甲醛(HCHO) D.乙酸
(3) 已知在生物质气化炉中可发生:
C(s)+CO2(g)═2CO(g);△H=+172kJ/mol
CH4(g)+H2O(g)═CO(g)+3H2(g);△H=+206kJ/mol
CH4(g)+2H2O(g)═CO2(g)+4H2(g);△H=+165kJ/mol
则C(s)+H2O(g)═CO(g)+H2(g);△H=____________kJ/mol.
(4)由生物质能获得的CO和H2可以用来合成液态燃料甲醇,实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:_________________。
(5) 己知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料。用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
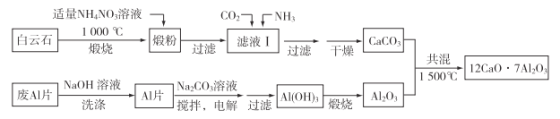
(1)煅粉主要含MgO和____________,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶;若滤液Ⅰ中c(Mg2+)小于5×10-6 mol·L-1,则溶液pH大于________[Mg(OH)2的Ksp=5×10-12];该工艺中不能用(NH4)2SO4代替NH4NO3,原因是_________________。
(2)滤液Ⅰ中的阴离子有________(忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成_________________,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为____________。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为____________。
(5)一种可超快充电的新型铝电池,充放电时AlCl![]() 和Al2Cl
和Al2Cl![]() 两种离子在Al电极上相互转化,其他离子不参与电极反应,放电时负极Al的电极反应式为__________________________________。
两种离子在Al电极上相互转化,其他离子不参与电极反应,放电时负极Al的电极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在学习了化学反应速率知识后,某研究性学习小组进行了科学探究活动。
[探究活动一]探究金属与不同酸反应的反应速率:常温下,用经过砂纸打磨的铝片中取两片质量相等、表面积相同的铝片,分别加入到盛有体积相同、c(H+)相同,足量的稀硫酸和稀盐酸溶液的两支试管中,发现铝片在稀盐酸中消失的时间比在稀硫酸中短。
(1)对[探究活动一]实验现象发生的原因,请你帮该研究性学习小组提出两个假设:
假设Ⅰ_______________________________。
假设Ⅱ_______________________________。
并请你设计实验对以上假设进行验证:
验证假设Ⅰ_______________________________。
验证假设Ⅱ_______________________________。
[探究活动二]某小组在实验室测定氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率。
(2)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡状态的是 .
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数: .
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量 (填“增加”、“减小”或“不变”).
④氨基甲酸铵分解反应的焓变△H 0,熵变△S 0(填>、<或=).
(3)已知:NH2COONH4+2H2ONH4HCO3+NH3H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如下图所示.
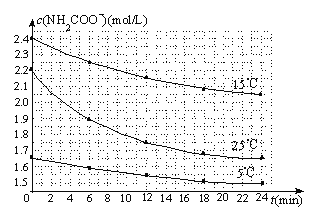
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率: .
⑥根据图中信息,如何说明水解反应速率随温度升高而增大: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com