
【题目】工业合成氨是利用氮气和氢气在一定条件下反应生成的。氨是重要的工业原料。请回答下列问题:
(1)氮元素在周期表中的位置是第_______周期第_______族;氮原子结构示意图为________________;
(2)写出氨分子的电子式______;指出分子中化学键是_____(填‘离子键’或‘共价键’)。
(3)写成合成氨的化学方程式:________________________;该反应是放热反应,则相同条件下“1molN2和3molH2”的能量与“2molNH3”的能量较高的是________________;
【答案】 .第2周期 ⅤA族 ![]()
![]() 共价键 N2+3H2
共价键 N2+3H2![]() 2NH3 1molN2和3molH2
2NH3 1molN2和3molH2
【解析】试题分析:(1)氮元素原子序数是7,氮原子有2个电子层,最外层有5个电子;
(2)氨气是共价化合物;氮原子、氢原子通过共价键结合。
(3)氮气、氢气在高温、高压、催化剂的条件下生成氨气;放热反应,反应物的总能量大于生成物的总能量。
解析:(1)氮元素原子序数是7,氮原子有2个电子层,最外层有5个电子;氮元素在周期表中的位置是第二周期第ⅤA族;氮原子结构示意图为![]() ;
;
(2)氨气是共价化合物,电子式为![]() ;氮原子、氢原子通过共价键结合。
;氮原子、氢原子通过共价键结合。
(3)氮气、氢气在高温、高压、催化剂的条件下生成氨气,反应方程式为N2+3H2![]() 2NH3 ;放热反应反应物的总能量大于生成物的总能量,相同条件下“1molN2和3molH2”的能量与“2molNH3”的能量较高的是1molN2和3molH2。
2NH3 ;放热反应反应物的总能量大于生成物的总能量,相同条件下“1molN2和3molH2”的能量与“2molNH3”的能量较高的是1molN2和3molH2。


科目:高中化学 来源: 题型:
【题目】人们对苯的认识有一个不断深化的过程。已知分子式为 C6H6的结构有多种,其中的两种为:
Ⅰ.![]() Ⅱ.
Ⅱ.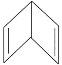
(1)这两种结构的化学性质区别表现在:Ⅰ能________(填字母,下同),而Ⅱ能________。
A.被酸性KMnO4溶液氧化
B.与溴水发生加成反应
C.与氢气发生加成反应
(2)1 mol C6H6与H2发生完全加成反应,Ⅰ需________molH2,而Ⅱ需________mol H2。
(3)今发现C6H6还可能有另一种如下图所示的立体结构,该结构的二氯代物有_________种。
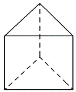
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为2K2S2+KI3![]() K2S4 +3KI。装置(Ⅱ)为电解池的示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法不正确的是( )
K2S4 +3KI。装置(Ⅱ)为电解池的示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法不正确的是( )
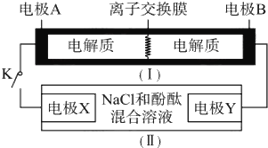
A. K+从左到右通过离子交换膜 B. 电极A上发生的反应为I3-+2e-=3I-
C. 电极Y上发生的反应为2Cl--2e-=Cl2↑ D. 当有0.1 molK+通过离子交换膜,X电极上产生1.12L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式,正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式_______________________________;
(2)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的?________(填“能”或“否”)。理由是______________________。
(二)该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:

(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是:_______________________________________________________________________。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式___________________。
(三)问题讨论:
有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性差(Cu+→Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一元醇的化学式为C6H14O,已知其分子中有二个—CH3、三个—CH2—、一个![]() ,此一元醇可能的结构有
,此一元醇可能的结构有
A. 4种 B. 5种 C. 6种 D. 7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。则下列说法正确的是
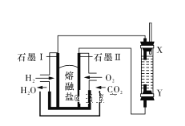
A. 石墨电极Ⅱ处的电极反应式为O2+4e-===2O2-
B. X是铁电极
C. 电解池中的电解液为蒸馏水
D. 若将电池两极所通气体互换,X、Y两极材料也互换,实验方案更合理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液化石油气的主要成分为丙烷,在燃烧时能放出大量的热,作为能源应用于人们的日常生产和生活。
已知:①C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l)△H1=-2219.9kJ/mol
3CO2(g)+4H2O(l)△H1=-2219.9kJ/mol
②2COg)+O2(g)═2CO2(g)△H2=-566kJ/mol
(l)反应2C3H8(g)+7O2(g)═6CO(g)+8H2O(l)的△H=______.
(2)C3H8在不足量的氧气里燃烧,生成CO和气态水,以它们为原料制备甲醇的工业流程如下:
![]()
反应室1为一个容积为10 L的密闭容器,在850℃发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g),CO(g)和H2O(g)浓度随反应时间的变化如下图所示:

0~4 min的平均反应速率v(CO2)= ___,该反应在850℃时的化学平衡常数K= ___.
(3)恒压下,0.2 mol CO2与0.6 mol H2在催化剂作用下在反应室2(容器的容积可变)中发生反应生成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H ,CO2的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)+H2O(g) △H ,CO2的平衡转化率与温度、压强的关系如图所示。

①该反应的△H __ 0(填“<”或“>”)。
②压强P1 __ p2(填“<”或“>”)。
③在P1、100℃条件下,反应达到平衡后再向容器中加入0.1 mol CO2和0.3 mol H2,反应重新达到平衡时,CO2的平衡转化率____50%(填“<”“>”或“=”),CH3OH 的平衡体积分数____(填“增大”“不变”或“减小”)。
④将a点的平衡混合物通入1 L 0.15 mol/LNaOH溶液中,充分吸收后,所得溶液中的溶质除甲醇外,还有____,所得溶液中各离子的物质的量浓度由大到小的顺序为________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com