
(共6分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g) 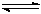 Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
(1)该反应的氧化剂是 ,2molN2参加反应转移电子数为 。
(2)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。
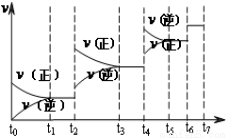
图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。
(3)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是
(提示:272 = 729)
(1)氮气, 12NA (2) 升高温度或增大压强,t3~t4;(3 ) 50% 。
【解析】
试题分析:(1)化合价降低的反应物是氧化剂,氮元素化合价0价变化为-3价,化合价降低,所以氮气做氧化剂,每2molN2反应电子转移12mol,2molN2参加反应转移电子数为12NA;(2)t4时正逆反应速率都较原平衡时的速率大,可升高温度或增大压强;t6时正逆反应速率都较原平衡时的速率大,但平衡不移动,前后气体系数之和不等,只能是使用催化剂;在t4时反应向逆反应方向移动,则t3~t4时平衡混合物中CO的含量最高;(3)设反应的N2的物质的量为x,
3SiO2(s)+6C(s)+2N2(g) 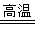 Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
起始:2mol 0
转化:x 3x
平衡:2-x 3x
则平衡时N2的浓度为(2-x)mol/L,CO的浓度为3x mol/L,则有: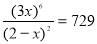 ,解之得x=1,
,解之得x=1,
则N2的转化率是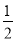 ×100%=50%。
×100%=50%。
考点:考查化学平衡的计算、氧化还原反应、化学平衡的影响因素。


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源:2014-2015河南省高一上学期第三次考试化学试卷(解析版) 题型:选择题
某学生用NaHCO3和KHCO3组成的混合物样品与某种浓度的盐酸反应进行实验,测得数据如下表:
分析表中数据,下列说法中不正确的是

A.由①、②可知:①中的盐酸过量
B.由②、③可知:混合物的质量增加,而气体体积没有变化,说明盐酸已经反应完全
C.所用盐酸的物质的量浓度为0.4 mol·L-1
D.该混合物中NaHCO3的物质的量分数为50%
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二上学期第三次考试化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中,一定能大量共存的是
①c(H+)=10-12 mol·L-1的溶液中:I-、NO3-、SO32-、K+
②中性溶液中:Fe3+、NO3-、Na+、SO42-
③由水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、NO3-、Cl-
④使甲基橙变黄色的溶液中:CO32-、Na+ 、AlO2-、SO42-
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高一上学期月考化学试卷(解析版) 题型:选择题
把7.4 g Na2CO3·10H2O和NaHCO3组成的固体混合物溶于水配成100 mL溶液,其中c(Na+)=0.6 mol·L-1。若把等质量的固体混合物加热至恒重,残留固体的质量是
A.3.18 g B.2.12 g C.4.22 g D.5.28 g
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高一上学期月考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA
B.22.4L SO2含有NA个SO2分子
C.1.6g CH4所含的电子数为NA
D.标况下,4.48L的水中含有H2O分子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高二上学期月考化学试卷(解析版) 题型:填空题
(共7分)硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI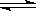 H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
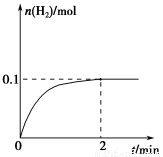
0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g) 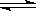 2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高二上学期月考化学试卷(解析版) 题型:选择题
将1L 0.1 mol·L-1 BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1L 0.5 mol·L-1 HCl溶液与足量CH3COONa溶液充分反应放出b kJ热量(不考虑醋酸钠水解);将0.5L 1 mol·L-1 H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为
A.(5a-2b) kJ B.(4b-10a) kJ
C.(5a+2b) kJ D.(10a+4b) kJ
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省高二上学期1月质量检测化学试卷(解析版) 题型:选择题
常温下,有下列4种溶液,下列说法正确的是
① | ② | ③ | ④ |
0.1 mol·L-1 CH3COOH溶液 | pH=3 CH3COOH溶液 | 0.1 mol ·L-1 NaOH溶液 | pH=11 NaOH溶液 |
A.由水电离出的c(H+):③>①
B.①稀释到原来的100倍后,pH与②相同
C.①与③混合,若溶液pH=7,则两种溶液的体积:③>①
D.②与④混合,若溶液pH=7,则两种溶液的体积:④>②
查看答案和解析>>
科目:高中化学 来源:2014-2015内蒙古巴彦淖尔市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列化合物中依次属于氧化物、碱、盐的一组是
A.Na2CO3、KOH、CaO B.CO、NaOH、KCl
C.H2O、H2SO4、NaCl D.CuO、Cu2(OH)2CO3、CaCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com