
下面涉及的是工业生产硝酸铵的过程。
(1)写出NO2和水反应的化学方程式,并标出电子转移的方向和数目。 。
(2)已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H= 一1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H= +180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ,
氨催化氧化生成NO反应的化学平衡常数表达式K= 。
(3)已知:N2(g)+3H2(g)
 2NH3(g) △H=-92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
2NH3(g) △H=-92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
A.升高温度 B.使用催化剂
C.及时移出氨 D.循环利用和不断补充氮气
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为 。
(5)许多有机物在特定的装置内进行氧化的同时还可产生电能,这种装置即为燃料电池。
例如,乙烯被氧化生成乙醛的化学反应:2CH2=CH2 + O2 →2CH3CHO可设计成燃料电池:
正极为:O2+4H++4e-=2H2O 负极为:
电池工作时,负极附近溶液的pH (填“升高”、“降低”或“不变”)。
(1)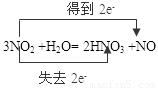 (电子转移省略 )(写出方程式1分,电子转移1分) (2分
)
(电子转移省略 )(写出方程式1分,电子转移1分) (2分
)
(2)4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol
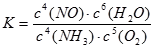
(3)CD
(4)30%(或29.9%)
(5)CH2=CH2+H2O–2e— = CH3CHO+2H+ 降低
【解析】
试题分析:(1)3 mol NO2与水发生反应,有1 mol 被还原为NO,2 mol 被氧化为硝酸,转移电子2 mol,NO2既是氧化剂又是还原剂;(2)根据盖斯定律,消去中间产物氮气可得,K等于生成物浓度的系数次方的乘积除以反应物浓度的系数次方的乘积;(3)提高氢气转化率,就是改变条件让平衡向右移动,结合勒夏特列原理,CD符合; (4)列出三段式,根据氨气的体积分数可得;(5)用总反应减去正极反应可得,负极产生H+,pH降低 。
考点:考查化学反应原理。


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
阅读下面材料,并回答问题:铝可以从铝土矿中获取。铝土矿是不纯净的铝的氧化物(杂质为Fe2O3和SiO2),它是非再生资源。假如我们对铝的消费保持现有的速度,我们获得生产足够的铝所需的铝土矿仅能维持30年左右。由此看来,保护现有自然资源和对非再生资源的再利用,是值得我们考虑的。但废物回收仍有相当大的难度,其关键的因素主要涉及旧金属的收集、与其它废物的分离,回收和提炼金属的费用、金属本身的价值等(已知1mol电子电量约为105C)。
(1)试说明回收铝的过程中存在的困难 。
(2)为什么金的回收率比铝的回收率要大得多?
(3)常温下,SiO2与强碱或强酸是很难反应的。现利用盐酸、氢氧化钠溶液、氨气、二氧化碳和水从铝土矿中提取纯净的Al2O3。试设计一个适用于工业生产上提纯Al2O3的实验方案。用化学方程式表示。
(4)假定用6V直流电源供电进行电解,制2.7吨Al需要多少kJ的电能?
(5)如果每度电的费用为0.60元,试计算生产厂家每生产1吨铝需付出的电费为多少元?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com