
c(N
| ||
| c(NH��3H2O) |
| c(NH��3H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
| T/K | 303 | 313 | 323 |
| NH3������/��10-6mol�� | 4.8 | 5.9 | 6.0 |
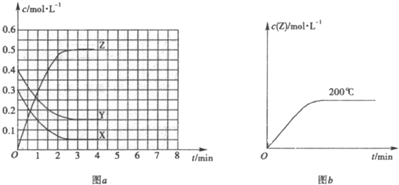
| 1 |
| 2 |
| c2(Z) |
| c(X)c(Y) |
| (0.5mol/L)2 |
| 0.05mol/L��0.15mol/L |
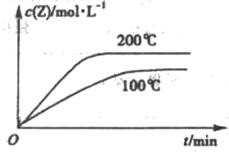 ��
�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/��mol?L-1�� | 0.64 | 0.50 | 0.50 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢ڢܢ� | B���٢ڢۢܢ� |
| C���٢� | D���٢ܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��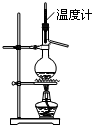 ʵ������ͼ��ʾװ����ȡ��ϩ |
| B����ˮ�������c��H+��=10-13mol?L-1����Һ�У�Na+��ClO-��K+��I-һ���ܴ������� |
| C����������Ҫ�ɷ��Ǹ�֬������ |
| D��ij�¶���Fe��OH��3��KSP=4��10-38������¶��£�������Һ��c��OH-��=2��10-19 mol?L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
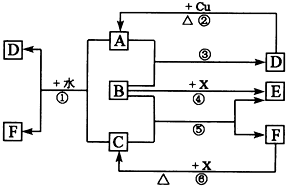 ���и�����Ϊ��ѧ��ѧ�г������ʣ�����A��C��E��FΪ���壬B��DΪ��ɫҺ�壬D��һ����Ҫ�Ļ���ԭ�ϣ�F��Ũ��Һ��X����ͨ������ʵ�����Ʊ�����C��X��һ�ֺ�ɫ��ĩ��B��������18�����ӣ�A���γ��������Ҫ���壮��Ӧ�в�������������ȥ��
���и�����Ϊ��ѧ��ѧ�г������ʣ�����A��C��E��FΪ���壬B��DΪ��ɫҺ�壬D��һ����Ҫ�Ļ���ԭ�ϣ�F��Ũ��Һ��X����ͨ������ʵ�����Ʊ�����C��X��һ�ֺ�ɫ��ĩ��B��������18�����ӣ�A���γ��������Ҫ���壮��Ӧ�в�������������ȥ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ά��������ά��ͭ����ά��������ά�����ɷֶ������� |
| B��������ˮ��������ע��Һ�����ܲ��������ЧӦ�������ڽ��� |
| C����������ǿ����ڲⶨ������Ĺ����š�1H�˴Ź����ǿ�ȷ��H�����Ļ�ѧ���� |
| D���ý��ݹ����������Һ�Ĺ���������ˮ���ͷŵ���ϩ���ɵ���ˮ�����ʵ�Ŀ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ���ű������� |
B�� �����̿�� |
C�� ������ú¯�� |
D�� ľͷ���߸� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �ŵ� |
| ��� |
| A����صĵ��ҺΪ������Һ������ΪNi2O3������ΪFe |
| B����طŵ�ʱ��������ӦΪFe+2OH--2e-�TFe��OH��2 |
| C����س������У�����������Һ��pH���� |
| D����س��ʱ��������ӦΪ2Ni��OH��2+2OH--2e-�TNi2O3+3H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ֽ�������������֡�ʯ���ߡ�̼��ά��ǿ�մɶ��dz����ĸ��ϲ��� |
| B�������ʡ��������ᡢPVC�����ۡ���֬�����ɸ߷�����ɵ����� |
| C��SiO2�ƳɵIJ�����ά�����ڵ�������ǿ������������ͨѶ���� |
| D��ú��������Һ�������������̺�ɱ�Ϊ�����Դ������ú�ۺ����õ���Ҫ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com