
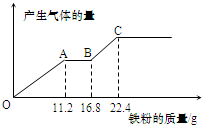
 取某稀硫酸和稀硝酸的混合溶液100mL.向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸被还原为NO气体).下列分析或结果正确的是( )
取某稀硫酸和稀硝酸的混合溶液100mL.向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸被还原为NO气体).下列分析或结果正确的是( )| A. | 最终溶液中所含的溶质为FeSO4 | |
| B. | OA段产生的气体是H2,BC段产生的气体是NO | |
| C. | 整个反应中转移电子数为1.2mol | |
| D. | 混合酸中NO3-的物质的量为0.2 mol |
分析 由图象可知,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑;根据发生的反应结合图示数据进行相应的计算即可.
解答 解:由图象可知,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑;
A、根据发生的反应,铁元素最终以亚铁离子存在,所以最终溶液中所含的溶质为FeSO4,故A正确;
B、OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,OA段产生的气体是NO,BC段产生的气体是H2,故B错误;
C、OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,OA段产生的气体是NO,即消耗11.2g铁即0.2mol,转移电子是0.6mol,BC段发生反应为:Fe+2H+=Fe2++H2↑,BC段产生的气体是H2,消耗金属铁22.4g-16.8g=5.6g即0.1mol金属铁消耗转移电子是0.2mol,AB段发生反应为:Fe+2Fe3+=3Fe2+,该段消耗金属铁5.6g,转移电子是0.2mol,所以整个反应中转移电子数为1.0mol,故C错误;
D、根据OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,消耗金属铁11.2g即0.2mol,消耗硝酸根是0.2mol,混合酸中NO3-的物质的量为0.2mol,故D正确.
故选AD.
点评 本题以化学反应图象为载体,考查有关金属和酸反应的计算题,难度中等,关键根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用,注意利用守恒思想解答.


科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间的延长而变化 | |
| B. | 单位时间内每消耗m个A分子的同时也生成了d个D分子 | |
| C. | 单位时间内每生成e个C分子的同时也生成了n个B分子 | |
| D. | A、B、C、D四种物质的分子数之比为m:n:e:d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.
铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
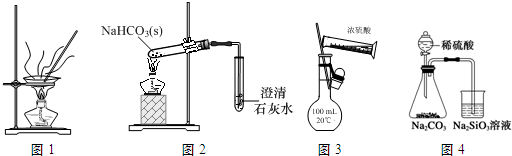
| A. | 用图1装置灼烧CuSO4•5H2O晶体除去结晶水 | |
| B. | 用图2装置探究NaHCO3的热稳定性 | |
| C. | 用图3装置配制100 mL 0.1 mol•L-1的硫酸 | |
| D. | 用图4装置比较硫、碳、硅三种元素的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | X | Y | Z | W |  |
| A | Cu[ | CuSO4[来 | Cu(OH)2 | CuO | |
| B | Na | NaOH | NaCl | NaHCO3 | |
| C | 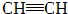 | CH2=CH2 | CH3CH3 | CH3CH2Cl | |
| D | Mg | MgO | MgSO4 | MgCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
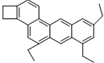 如图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”,有关doggycene的说法正确的是 ( )
如图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”,有关doggycene的说法正确的是 ( )| A. | 该分子中所有碳原子可能处于同一平面 | |
| B. | doggycene的分子式为:C26H30 | |
| C. | 1mol该物质在氧气中完全燃烧生成CO2和水的物质的量之比为1:1 | |
| D. | 该物质常温为气态. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com