
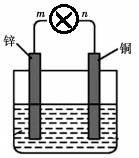
 将质量均为100g的锌片和铜片用导线与灯泡串联浸入盛有500mL 2mol•L-1稀硫酸溶液的1.5L容器中构成如图装置.
将质量均为100g的锌片和铜片用导线与灯泡串联浸入盛有500mL 2mol•L-1稀硫酸溶液的1.5L容器中构成如图装置.分析 (1)该装置构成原电池,负极上锌溶解,正极上氢离子放出氢气,总的离子方程式为锌与氢离子反应生成锌离子和氢气,阴离子流向负极;
(2)负极上锌溶解,电极反应为:Zn-2e-=Zn 2+,据此计算导线中流过的电子;电子的流动方向为负极流向正极;由v=$\frac{△c}{△t}$计算反应开始至2min用该气体表示的反应速率;
(3)当反应进行到3min 时灯泡亮度较弱,根据加入电解质时离子浓度增大即可增强溶液的导电性会使灯泡的亮度突然增加判断.
解答 解:(1)该装置构成原电池,负极上锌溶解,正极上氢离子放出氢气,总的离子方程式为2H++Zn=Zn2++H2↑,阴离子流向负极,所以SO42-流向负极锌极,故答案为:2H++Zn=Zn2++H2↑;SO42-;
(2)负极上锌溶解,电极反应为:Zn-2e-=Zn 2+,正极上氢离子放出氢气,电极反应为:2H++2e-=H2↑,所以锌片质量减少13g,则导线中流过的电子为$\frac{13g}{65g/mol}$×2=0.4mo1,生成氢气为0.2mol;电子的流动方向为负极m流向正极 n;又正极生成的气体不断导入一个2L的刚性容器中,则反应开始至2min用该气体表示的反应速率v=$\frac{△c}{△t}$=$\frac{\frac{0.2mol}{2L}}{2min}$=0.5mol•L-1•min-1;故答案为:0.4;由m到 n;0.5mol•L-1•min-1;
(3)a.300mL蒸馏水,离子浓度减小,导电性减弱,灯泡的亮度会减弱,故错误;
b.100mL 8mol•L-1硫酸溶液,离子浓度增大,导电性增强,灯泡的亮度会增加,故正确;
c.300mL 10mol•L-1硫酸铜溶液,离子浓度增大,导电性增强,灯泡的亮度会增加,故正确;
d.200mL 8mol•L-1氢氧化钠溶液与硫酸反应导致离子浓度减小,导电性减弱,灯泡的亮度会减弱,故错误;
故选:bc.
点评 本题考查原电池知识,侧重于学生的分析能力和计算能力的考查,注意把握原电池的工作原理,把握电极方程式的书写,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 液化石油气主要含乙烯、丙烯和甲烷 | |
| B. | 限制氟利昂的使用是为了保护大气臭氧层 | |
| C. | 在船身适当位置装锌块可以避免船体遭受腐蚀 | |
| D. | 工业上冶炼像钠、钙、镁、铝这样的活泼金属,需采用电解法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 | |
| B. | 碱金属元素中,锂原子失去最外层电子的能力最弱 | |
| C. | 钾与水的反应比钠与水的反应更剧烈 | |
| D. | 因为非金属性Cl>S,盐酸的酸性比氢硫酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法 | |
| B. | 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品 | |
| C. | 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小 | |
| D. | 用SO2水溶液吸收Br2的离子反应方程式为Br2+SO2+2H2O═4H++SO42-+2Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Z元素与氯元素通过离子键化合形成对应的氯化物 | |
| B. | 原子半径:Y>Z>W>X | |
| C. | Y 的最高价氧化物对应的水化物可溶于氯化铵溶液 | |
| D. | 气态氢化物的热稳定性:X>W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com