
【题目】下列关于金属Na的叙述中,说法正确的是
A. Na在空气中燃烧,发出黄色火焰 B. Na在空气中燃烧,产物是Na2O
C. Na是银白色金属,硬度大,熔点高 D. Na常温和加热时反应,产物一样
科目:高中化学 来源: 题型:
【题目】若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的转化。在转化的各阶段被破坏的粒子间的主要相互作用依次是
A. 氢键;分子间作用力;非极性键
B. 氢键;氢键;极性键[
C. 氢键;极性键;分子间作用力
D. 分子间作用力;氢键;非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如右图所示,其中固体电解质只允许Li+通过。下列说法正确的是
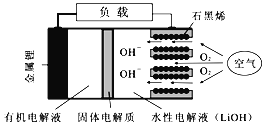
A. 放电时,负极反应式:Li-e-+OH-=LiOH
B. 放电时,当外电路中有1 mol e-转移时,水性电解液离子总数增加NA
C. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗11.2 L O2
D. Li+穿过固体电解质向正极移动而得到LiOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-![]() Zn(OH)2、Ag2O+H2O+2e-
Zn(OH)2、Ag2O+H2O+2e-![]() 2Ag+2OH-。根据上述电极反应,判断下列叙述中正确的是
2Ag+2OH-。根据上述电极反应,判断下列叙述中正确的是
A.在使用过程中,电池负极区溶液的pH增大
B.在使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn电极发生还原反应,Ag2O电极发生氧化反应
D.Zn是负极,Ag2O是正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,请根据图中给出的信息,指出下列有关说法中正确的是(纵坐标为化合价的变化,横坐标为原子序数的变化)( ) 
A.原子半径:W>Z>Y
B.气态氢化物的稳定性:H2X<H2W
C.Y2X和水反应能生成离子化合物
D.Y和Z两者氧化物对应的水化物不能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤是重要的能源和化工原料,直接燃烧既浪费资源又污染环境。最近,某企业利用“煤粉加压气化制备合成气新技术”,让煤变成合成气(一氧化碳及氢气总含量≥90%),把煤“吃干榨尽”。下列有关说法正确的是( )
①煤粉加压气化制备合成气过程涉及化学变化和物理变化
②煤粉加压气化制备合成气过程涉及化学变化但没有物理变化
③该技术实现了煤的清洁利用
④该技术实现了煤的高效利用
A.①②③ B.①②④
C.①③④ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一体积固定装有H2、CO、CO2混合气体的密闭容器,向其中加入过量的Na2O2,并不断用电火花点燃使其充分反应,反应结束后恢复至起始温度,测得容器内的压强(固体体积忽略不计)是起始状态的1/4。则原混合气体的平均相对分子质量可能是
A. 20g/mol B. 23g/mol C. 30g/mol D. 36g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2015江苏][双选]在体积均为1.0 L的两恒容密闭容器中加入足量的相同的炭粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
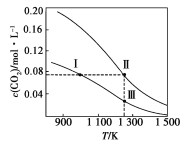
A.反应CO2(g)+C(s)![]() 2CO(g)的ΔS>0、ΔH<0
2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)>2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁钾矾[KxFey(SO4)m·nH2O]常用作工业媒染剂。其组成可用如下方法测定:
①准确称取2.0120g样品配成100mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.466g。
③准确量取25.00mL溶液A,加入足量的KI溶液,以淀粉为指示剂,用0.1250 mol·L-1的Na2S2O3溶液滴定,消耗8.00mL至终点(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。
(1)要检验出A溶液中存在的Fe3+,可以加入 溶液。
(2)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-5 molL-1,应保持溶液中c(Ba2+)≥ mol·L-1。
(3)步骤③中判断滴定终点的方法是 。
(4)通过计算确定铁钾矾的组成(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com