
| A. | 2,2-二甲基丁烷 | B. | 2-甲基-5-乙基-1-己烷 | ||
| C. | 3-甲基-2-丁烯 | D. | 3,3-二甲基-2-戊烯 |
分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
(1)烷烃命名原则:
①长:选最长碳链为主链;
②多:遇等长碳链时,支链最多为主链;
③近:离支链最近一端编号;
④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;
⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;
(2)有机物的名称书写要规范;
(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;
(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A.符合命名规则,故A正确;
B.最长碳链为7个碳,命名为:2,5-二甲基-庚烷,故B错误;
C.取代基的位次和最小,应为2-甲基-2-丁烯,故C错误;
D.3号碳上接了5个键,碳原子最多接4个键,故D错误.
故选A.
点评 本题考查有机物的命名方法判断,题目难度中等,注意掌握常见有机物的命名原则,试题有利于培养学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
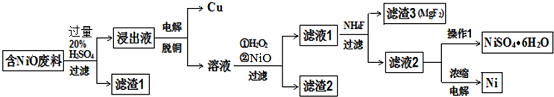
| 物质 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.5 | 3.6 | 7.3 | 7.0 | 9.6 |
| 完全沉淀 | 3.8 | 4.7 | 9.3 | 9.0 | 12.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .第一电离能最小的元素是Cu(填元素符号).
.第一电离能最小的元素是Cu(填元素符号).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精能使蛋白质变性,医学上使用无水酒精来杀菌消毒 | |
| B. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| C. | ClO2具有强氧化性,可用于自来水的杀菌消毒,有优于氯气的高效安全性 | |
| D. | Na2CO3能与盐酸反应,广泛用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
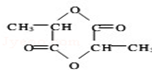 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
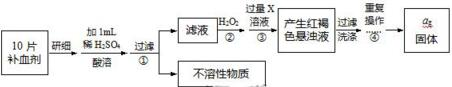
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com