
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH ![]() +6HCHO═3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
+6HCHO═3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ称取样品1.500g.
步骤Ⅱ将样品溶解后,完全转移到250mL容量瓶中,定容、充分摇匀.
步骤Ⅲ移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数(填“偏高”“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积(填“偏大”“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察 .
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由色变成色.
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.101 0molL﹣1 , 则该样品中氮的质量分数为(保留4位有效数字)
【答案】
(1)偏高;无影响;B;无;粉红(或浅红)
(2)18.85%
【解析】解:(1)①碱式滴定管用蒸馏水洗涤后需要再用NaOH溶液润洗,否则相当于NaOH溶液被稀释,滴定消耗的体积会偏高,测得样品中氮的质量分数也将偏高,
所以答案是:偏高;
②锥形瓶用蒸馏水洗涤后,虽然水未倒尽,但待测液中的H+的物质的量不变,则滴定时所需NaOH标准溶液中的氢氧化钠的物质的量就不变,也就是无影响,
所以答案是:无影响;
③定时边滴边摇动锥形瓶,眼睛应注意观察颜色变化,确定滴定终点,所以答案是:B;
④待测液为酸性,酚酞应为无色,当溶液转为碱性时,溶液颜色变为粉红(或浅红),所以答案是:无;粉红(或浅红);
(2)标准溶液的体积应取三次实验的平均值,
首先确定滴定时所用的NaOH标准溶液为 ![]() mL=20.00mL,
mL=20.00mL,
根据题意中性甲醛溶液一定是过量的,而且1.500g 铵盐 经溶解后,取了其中 ![]() 进行滴定,即0.15g,
进行滴定,即0.15g,
滴定结果,溶液中含有H+(含(CH2)6N4H+)共0.02L××0.1010mol/L=0.00202mol,
根据4NH4++6HCHO═3H++6H2O+(CH2)6N4H+ , 每生成4molH+(含(CH2)6N4H+),会消耗NH4+4mol,
所以共消耗NH4+0.00202mol,
其中含氮元素0.00202mol×14g/mol=0.02828g
所以氮的质量分数为 ![]() ×100%=18.85%,
×100%=18.85%,
所以答案是:18.85%.


科目:高中化学 来源: 题型:
【题目】我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示).下列做法与上述理念相违背的是( ) 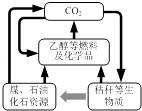
A.大力发展煤的气化及液化技术
B.加快石油等化石燃料的开采和使用
C.以CO2 为原料生产可降解塑料
D.将秸秆进行加工转化为乙醇燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10﹣10 , Ksp(AgI)=1.0×10﹣16 . 下列说法错误的是( )
A.AgCl不溶于水,不能转化为AgI
B.在含有浓度均为0.001 mol?L﹣1的Cl﹣、I﹣的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ![]() ×10﹣11mol?L﹣1
×10﹣11mol?L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向V mL pH=a的盐酸中,滴加10V mL pH=b的NaOH溶液,所得溶液中Cl﹣的物质的量恰好等于Na+的物质的量,则a+b的值是( )
A.15
B.14
C.13
D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列颜色变化与氧化还原反应无关的是( )
A.长期放置的苯酚晶体变红B.硝酸银晶体光照后变黑
C.氢氧化亚铁变灰绿再变红褐D.二氧化氮气体冷却后变淡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重水(D2O)是重要的核工业原料,下列说法正确的是
A.氘(D)的原子核外有2个电子B.1H与D是同一种原子
C.H2O与D2O互称同素异形体D.1H218O与D216O的相对分子质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,可行的是 ( )
A.将白醋滴在润湿的pH试纸上,测定其pH
B.按溶解、过滤、蒸发的操作顺序分离CaCl2、CaCO3的混合物
C.用氢氧化钠溶液除去CO2中的HCl气体
D.检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N和Si是合成新型非金属材料的两种重要元素.请回答:
(1)基态Si原子的价层电子排布图为;其2p能级的轨道有个伸展方向,电子云的形状为 .
(2)Si原子可形成多种氢化物,其中Si2H4中Si原子的价层电子对数目为 , Si原子的杂化轨道类型为 .
(3)N和Si形成的原子晶体中,N原子的配位数为 .
(4)NaN3常作为汽车安全气囊的填充物,其焰色反应为黄色.大多数金属元素有焰色反应的微观原因为;N3﹣中σ键和π键的数之比为 . B、F与N三种元素同周期,三种基态原子的第一电离能由大到小的顺序为(用元素符号表示).
(5)NaNO2是一种重要的工业原料,NO2﹣的空间构型为 .
(6)SiO2的晶胞与金刚石(如图所示)相似,可以看作Si原子替代C原子后,在两个成键的Si原子间插入1个O原子形成. 
则:①晶胞中最小的环含有个原子.
②若晶体密度为ρgcm﹣3 , 阿伏伽德罗常数为NA , 晶胞中两个最近的Si原子核之间的距离为pm(用代数式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com