
| A. | 塑料制品 | B. | 天然油脂 | C. | 棉花 | D. | 人造橡胶 |
分析 高分子化合物(又称高聚物)一般相对分子质量高于10000,结构中有重复的结构单元;有机高分子化合物可以分为天然有机高分子化合物(如淀粉、纤维素、蛋白质天然橡胶等)和合成有机高分子化合物(如聚乙烯、聚氯乙烯等).
解答 解:A.塑料相对分子质量在一万以上,为合成高分子化合物,故A错误;
B.油脂相对分子质量较小,不是高分子化合物,故B错误;
C.棉花的成分是纤维素,纤维素为多糖,相对分子质量在一万以上,为天然高分子化合物,故C正确;
D.人造橡胶的成分是聚异戊二烯,相对分子质量在一万以上,为合成高分子化合物,故D错误.
故选C.
点评 本题考查天然高分子化合物,难度较小,明确物质的分子量是解题的关键,注意基础知识的积累掌握.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 比苯酚溶液大 | B. | 比苯酚溶液小 | ||
| C. | 与苯酚溶液相等 | D. | 无法和苯酚溶液比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
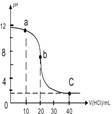
| A. | a点时,溶液呈碱性,溶液中c(B+)>c(Cl-) | |
| B. | b点时溶液的pH=7 | |
| C. | 当c(B+)=c(Cl-)时,v(HCl)<20mL | |
| D. | c点时溶液的c(H+)约为0.03mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
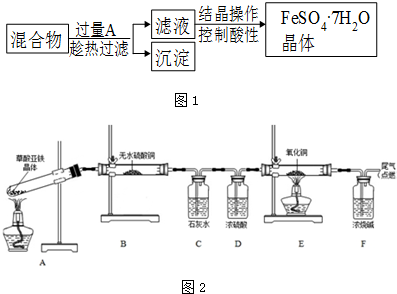
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
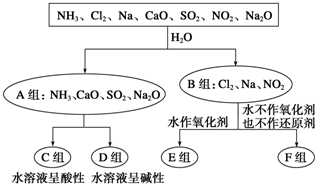
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g | B. | 13.6 g | C. | 5.8g | D. | 4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
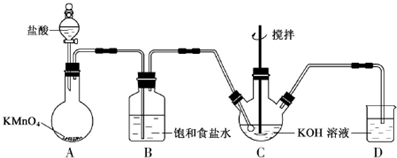
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com