
 ���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮
���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮| 10 |
| 3 |
| c(SO3) | ||
c(SO2)c
|
| ||||||
|
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1.2 |
| 2 |
| 18a |
| 64 |
| 82a |
| 64 |
| 82a |
| 64 |
| 98a |
| 64 |
| ||||
|


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ѡ�� | ���� | ���� | ���� |
| A | SO2ˮ��Һ�еμ������ữ��BaCl2��Һ | ������ɫ���� | BaSO3���������� |
| B | Al����ŨHNO3�� | ���������� | Al���汻ŨHNO3�����γ����ܵ�����Ĥ |
| C | Na2SiO3��Һ��ͨ��CO2���� | ������ɫ��״���� | H2SiO3�����Ա�H2CO3������ǿ |
| D | �ò�����պȡŨ��ˮ�㵽��ɫʯ����ֽ�� | ��ֽ����ɫ | Ũ��ˮ�ʼ��� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��X����λ�ڢ�A�� |
| B����Ԫ���γɵĻ������У�ԭ�Ӹ����Ȳ�������1��1 |
| C��X��Y�ļ����ӿ��ܾ�����ͬ�ĵ��Ӳ�ṹ |
| D�����³�ѹ�£�X2Y���������塢Һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ѧ��һ����ʵ��Ϊ��������Ȼ��ѧ����������ʵ��֪ʶ�ش��������⣮
��ѧ��һ����ʵ��Ϊ��������Ȼ��ѧ����������ʵ��֪ʶ�ش��������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
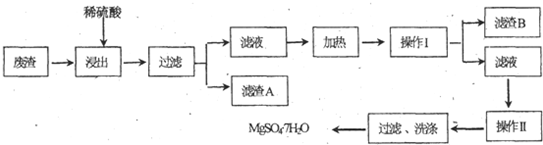

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ������ | Fe��OH��3 | Al��OH��3 | Cu��OH��2 | Mn��OH��2 | CuS | MnS | MnCO3 |
| ������ȫʱ��pH | 3.7 | 5.2 | 6.4 | 9.8 | ��0 | ��7 | ��7 |
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ԭ��صĸ����͵��ص������϶�����ʧ���ӵ�������Ӧ |
| B���ö��Ե缫���Na2SO4��Һ������������������ʵ���֮��Ϊ1��2 |
| C���Ʋ������������ȶ�п�������ʴ |
| D���ö��Ե缫��ⱥ��NaCl��Һ������1mol����ת�ƣ�������1mol NaOH |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com