
除去Na2CO3 固体中少量NaHCO3的最佳方法是( )。
A.加入适量盐酸 B.加热
C.加入NaOH溶液 D.配成溶液后通入CO2
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
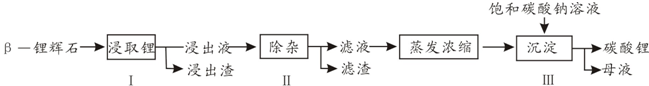
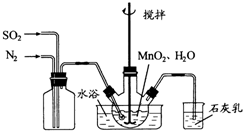 (2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
(2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下: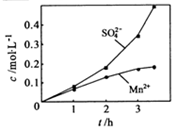
查看答案和解析>>
科目:高中化学 来源: 题型:

(2)足量的Fe粉与一定量的盐酸反应,反应速率太快,为了减慢反应速率,但又不影响产生氢气的总量,应加入下列物质中的___________。
A.水 B.NaCl(固) C.NaCl溶液 D.Na2SO4溶液
E.NaNO3溶液 F.NaOH溶液 G.Na2CO3溶液 H.NaAc溶液
I.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或PH值控制可参考下列附表确定
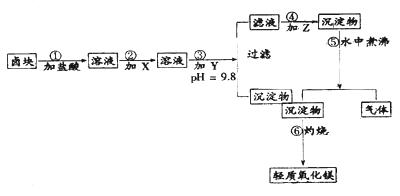
轻质氧化镁生产工艺流程图
表1 生成氢氧化物沉淀的PH值
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 | 2.7 7.6 8.3 9.6 | 3.7 9.6 9.8 11.1 |
*)注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常常将它氧化成为Fe3+,生成
Fe(OH)3沉淀而去除之。
表2 化学试剂价值表
| 试剂 | 价格(元/t) |
| 漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) | 450 2400 2100 600 310 |
请填写以下空白:
(1)在步骤②加入的试剂X,最佳选择应是 ,其作用是 。
(2)步骤③加入的试剂Y应是 ;之所以要控制pH=9.8,其目的是 。
(3)在步骤⑤时发生的化学反应方程式是:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省莆田一中高二下学期第一学段考试化学试卷(带解析) 题型:填空题
“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或pH值控制可参考下列附表确定。轻质氧化镁工艺流程图如下:

表1 化学试剂价格表
| 试剂 | 价格(元/ t ) |
| 漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) | 450 2400 2100 600 310 |
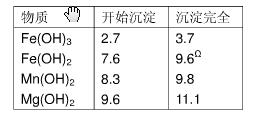
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 | 2.7 7.6 8.3 9.  6 6 | 3.7 9.6Ω 9.8 11.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com