
【题目】某兴趣小组探究以芒硝Na2SO4·10H2O和CaO为原料制备Na2CO3。
(1)将CaO水化后,与芒硝形成Na2SO4-Ca(OH)2-H2O三元体系,反应后过滤,向滤液中通入CO2,期望得到Na2CO3。三元体系中反应的离子方程式为: SO42-+ Ca(OH)2(s)+2H2O![]() CaSO4·2H2O(s)+2 OH-
CaSO4·2H2O(s)+2 OH-
该反应的平衡常数表达式K=_________________________。
往Na2SO4-Ca(OH)2-H2O三元体系中添加适量的某种酸性物质,控制pH=12.3 [即c(OH-)=0.02mol/L],可使反应在常温下容易进行。反应后过滤,再向滤液中通入CO2,进一步处理得到Na2CO3。
(2)在Na2SO4-Ca(OH)2-H2O三元体系中不直接通入CO2,其理由是_______________________________________________________________。
(3)添加的酸性物质须满足的条件(写出两点)是_____________、______________。
(4)用平衡移动原理解释添加酸性物质的理由:____________________________________;以HA表示所添加的物质,则总反应的离子方程式可写为_______________________。
(5)Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-。下列说法错误的是_________。
HCO3-+OH-。下列说法错误的是_________。
a.加水稀释,溶液中所有离子的浓度都减小
b.通入CO2,溶液pH减小
c.加入NaOH固体,![]() 减小
减小
d.稀释溶液,平衡常数增大
【答案】![]() 碱性条件下CO2与Ca2+生成难溶物CaCO3 不与Ca2+生成难溶物 酸性比碳酸弱 酸性物质与OH-反应,使平衡向生成CaSO4·2H2O的方向进行 SO42-+ Ca(OH)2+2HA
碱性条件下CO2与Ca2+生成难溶物CaCO3 不与Ca2+生成难溶物 酸性比碳酸弱 酸性物质与OH-反应,使平衡向生成CaSO4·2H2O的方向进行 SO42-+ Ca(OH)2+2HA![]() CaSO4·2H2O↓+2A- a d
CaSO4·2H2O↓+2A- a d
【解析】
(1)根据平衡常数表达式,该反应的平衡常数表达式K= ;
;
(2)①在碱性条件下CO2与Ca2+生成难溶物CaCO3,所以不直接通入CO2;
(3)加入酸性物质,氢离子可以中和氢氧根离子,使平衡向着生成CaSO42H2O的方向进行;以HA表示所添加的酸性物质,由于HA酸性要小于碳酸酸性,反正方程式中应该写成分子式,所以总反应的离子方程式为SO42﹣+Ca(OH)2+2HACaSO42H2O↓+2A﹣;
(5)a.加水稀释,平衡右移溶液中CO32-,HCO3-,OH-离子的浓度都减小,但氢离子浓度增大,错误;b.通入CO2,溶液酸性增加,pH减小,正确;c.加入NaOH固体,平衡左移,![]() 减小,正确;d.稀释溶液,平衡常数不变,错误;
减小,正确;d.稀释溶液,平衡常数不变,错误;


科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又是可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJmol1,2H2(g)+O2(g)═2H2O(g)△H=484kJmol1,工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式______________。
(2)工业上在恒容密闭容器中可采用下列反应合成甲醇CO(g)+2H2(g)![]() CH3OH(g)ΔH
CH3OH(g)ΔH
①能判断该反应达到平衡状态的依据是_________(填母序号)。
A.2 ν逆(H2) = ν 正(CO)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
F.CO、H2、CH3OH的速率之比为1:2:1
②CO在不同温度下的平衡转化率与压强的关系如图,该反应△H_______0(填“>”或“<”)。
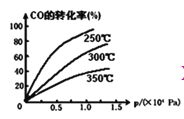
③一定温度下,将4a mol H2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应2C(s)+O2(g)![]() 2CO(g);2CO(g)+O2(g)
2CO(g);2CO(g)+O2(g)![]() 2CO2(g)都是放热反应。据此推断在相同条件下,下列说法不正确的是( )
2CO2(g)都是放热反应。据此推断在相同条件下,下列说法不正确的是( )
A.56 g CO和32 g O2所具有的总能量之和大于88 g CO2所具有的总能量
B.12 g C所具有的能量一定高于28 g CO所具有的能量
C.12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量
D.将两份质量相等的碳完全燃烧,生成CO2的反应比生成CO的反应放出的热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍,B在D的单质中充分燃烧能生成其最高价化合物BD2,E+与D2-具有相同的电子数。A在F是单质中燃烧,产物溶于水得到一种强酸。下列有关说法正确的是( )
A.工业上F单质用MnO2和AF来制备
B.B元素所形成的单质的晶体类型都是相同的
C.F所形成的氢化物的酸性强于BD2的水化物的酸性,说明F的非金属性强于B
D.由化学键角度推断,能形成BDF2这种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K2HPO4溶液呈碱性,即HPO42-结合H+的能力大于其电离产生H+的能力。下列操作能使该溶液中c(H3O+)增大的是( )
A.加水B.加热C.加消石灰D.加K2HPO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A ![]() B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:

根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为_____mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是____反应(选填吸热、放热)。理由是 __________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水解反应的离子方程式书写正确的是
A.Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.Cl+H2O![]() HCl+OH
HCl+OH
C.CO32-+2H2O![]() H2CO3+2OH
H2CO3+2OH
D.NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.氯化铝溶液与一定量的碳酸钠溶液反应:Al3++3CO32-+3H2O=Al(OH)3↓+3HCO3-
B.氯化钠固体与浓硫酸混合微热:Cl-+H+![]() HCl↑
HCl↑
C.氯气通入石灰乳:Cl2+2OH-=Cl-+ClO-+H2O
D.苯酚钠溶液呈碱性的原理:C6H5O-+H2O→C6H5OH+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有_______________(选填序号)。
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
(2)B分子所含官能团的名称是______________________________。
(3)B分子中没有支链,其结构简式是________________________,B的具有相同官能团的同分异构体的结构简式是_________________。
(4)由B制取A的化学方程式是____________________________________。
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取:
![]()
天门冬氨酸的结构简式是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com