
| A. | 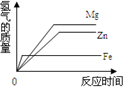 | B. | 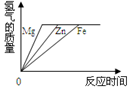 | C. | 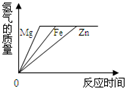 | D. | 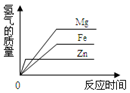 |
科目:高中化学 来源: 题型:选择题
| A. | 同质量的H2和Cl2含有的分子数相等 | |
| B. | SO42-的摩尔质量是96 g•mol-1 | |
| C. | 阿伏加德罗常数恰好为6.02×1023mol-1 | |
| D. | 1 mol CO2的质量为44 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
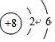 ;氮元素通常转化为化肥铵盐,铵根离子的电子式为
;氮元素通常转化为化肥铵盐,铵根离子的电子式为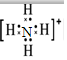 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 | |
| B. | 16O与18O的性质完全不同 | |
| C. | 氯原子的结构示意图 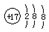 | |
| D. | 碳酸钠的电离方程式:Na2CO3=Na++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13653I是碘的一种同素异形体 | |
| B. | 13653I是一种新发现的元素 | |
| C. | 它的中子数是53 | |
| D. | 核内的中子数与核外电子数之差为30 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2、Cl2都可用于漂白物质,将等物质的量的两种气体同时作用于潮湿的有色布条时,可以增强漂白效果 | |
| B. | SO2能使品红溶液、溴水和酸性高锰酸钾溶液褪色,是因为SO2具有漂白性 | |
| C. | SO2通入紫色石蕊溶液中,溶液只变红不褪色 | |
| D. | Cl2通入紫色石蕊溶液中,溶液先变红后褪色. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com