
| A.加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 |
| B.用萃取的方法分离汽油和煤油 |
| C.用溶解、过滤的方法分离KNO3和NaCl固体的混合物 |
| D.将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.碱式滴定管用蒸馏水洗净后,直接加入未知浓度的NaOH溶液 |
| B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
| C.滴定前,没有逐出酸式滴定管尖嘴处的气泡,滴定终点时气泡消失 |
| D.滴定前读数正确,达到滴定终点后,俯视读数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将坩埚直接放在三角架上进行加热 |
| B.坩埚在加热前未完全干燥,可使测定的结果偏低 |
| C.加热温度过高,使一部分硫酸铜分解,可使测定结果偏高 |
| D.实验步骤的顺序为:称量、研磨、加热、冷却、称量、再加热、冷却、称量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 ~3次一并转入其中。
~3次一并转入其中。| 实验序号 | 滴定管液面起始读数 | 滴定管液面终点读数 |
| 1 | 1.32mL | 23.36mL |
| 2 | 2.26mL | 24.22mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
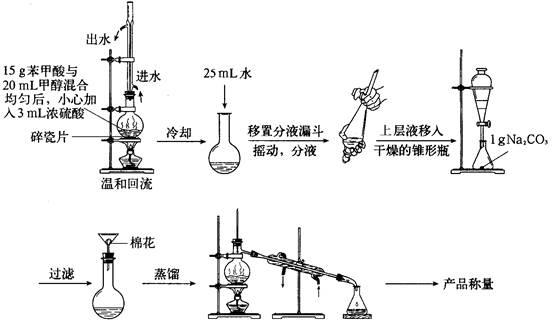

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.制取蒸馏水时,为防止烧瓶内产生暴沸现象,应事先向烧瓶中加入几片碎瓷片 |
| B.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2—3次 |
| C.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 |
| D.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③⑤①⑥⑦④ | B.④⑥①③②⑤⑦ |
| C.④②⑤⑥①③⑦ | D.②⑥⑦④③⑤① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 D.氢键 E.配位键 F.金属键 G.极性键
D.氢键 E.配位键 F.金属键 G.极性键
| | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯甲醛 | —26 | 179 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲酸 | 122 | 249 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲醇 | -15.3 | 205.0 | 稍溶于水,易溶于乙醇、乙醚 |
| 乙醚 | -116.2 | 34.5 | 微溶于水,易溶于乙醇 |
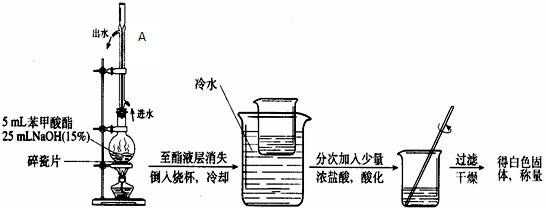
 萃取的效果 ▲ (填“好”或“差”)。
萃取的效果 ▲ (填“好”或“差”)。 馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代
馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代 号)。
号)。 冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。
冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某溶液中加入BaCl2溶液产生白色沉淀,说明一定含SO42- |
| B.除去生石灰中的石灰石,可加水后进行过滤 |
C.某无色溶液中滴入紫色石蕊 试液显红色,说明该溶液呈碱性 试液显红色,说明该溶液呈碱性 |
| D.可以用溶解、过滤、蒸发的方法除去BaCl2中的BaSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com