
| W | X | |
| Y | Z |
| A. | W单质的化学性质很活泼 | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X、Y、Z气态氢化物稳定性最弱的是Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
分析 W的气态氢化物可与其最高价含氧酸反应生成离子化合物,离子化合物为铵盐,则W为N,结合W、X、Y、Z四种短周期元素在元素周期表中的相对位置可知,X为O,Y为S,Z为Cl,然后结合元素周期律及元素化合物知识来解答.
解答 解:W的气态氢化物可与其最高价含氧酸反应生成离子化合物,离子化合物为铵盐,则W为N,结合W、X、Y、Z四种短周期元素在元素周期表中的相对位置可知,X为O,Y为S,Z为Cl,
A.W的单质为氮气,含碳碳三键,常温下性质稳定,故A错误;
B.非金属性Cl>S,则Z元素最高价氧化物对应水化物的酸性一定强于Y,而不是最高价无此规律,故B错误;
C.非金属性X>Y,Z>Y,则气态氢化物稳定性最弱的是Y,故C正确;
D.氯气与水或碱的反应中,氯气既有氧化性也有还原性,故D错误;
故选C.
点评 本题考查位置、结构与性质的综合应用,为高频考点,把握W为N元素、元素的位置、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意N元素为推断的突破口,题目难度不大.


 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| 实验一 | 实验二 | |
| 装置 | 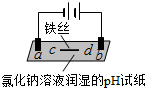 | 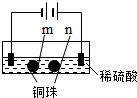 |
| 现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生;… |
| A. | a、d处:2H2O+2e-═H2↑+2OH- | |
| B. | b处:2Cl--2e-═Cl2↑ | |
| C. | c处发生了反应:Fe-2e-═Fe2+ | |
| D. | 根据实验一的原理,实验二中m处能析出铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$→_{高温}^{H_{2}}$Si | |
| B. | FeS2$→_{煅烧}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| D. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2FeO4是新型水处理剂,其原理与明矾相同 | |
| B. | 煤的气化是物理变化,是高效、清洁地利用煤的重要途径 | |
| C. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| D. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮藏罐贮运浓硫酸 | |
| B. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 | |
| C. | 次氯酸具有强氧化性,因此氯气可用于自来水的杀菌消毒 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

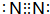 ;⑨的过氧化物
;⑨的过氧化物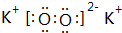 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| B. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| C. | 溴苯(溴单质):加NaOH溶液振荡,分液,弃水层 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g 14CH4所含中子数目为8NA | |
| B. | 标准状况下,22.4 L CCl4所含分子数目为NA | |
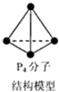
| C. | 6.2g白磷(分子式为P4,分子结构如图所示)所含P-P键数目为0.3NA | |
| D. | 1mol含8个碳原子的某烃分子,最多形成8NA个碳碳单键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com