
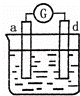
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 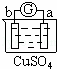
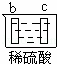
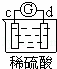
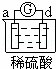
部分实验现象 a极质量减小
b极质量增加 b极有气体产生
c极无变化 d极溶解
c极有气体产生 电流计指示在导线中
电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A. a>b>c>d B. b>c>d>a C. d>a>b>c D. a>b>d>c
考点: 原电池和电解池的工作原理;常见金属的活动性顺序及其应用.
专题: 电化学专题.
分析: 根据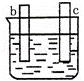 中发生化学腐蚀,活泼金属与酸反应放出氢气,不活泼金属与酸不反应;
中发生化学腐蚀,活泼金属与酸反应放出氢气,不活泼金属与酸不反应;
根据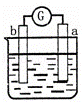 、
、 、
、 中发生电化学腐蚀,活泼金属作负极,不活泼金属作正极,负极发生氧化反应,正极发生还原反应,电子从负极经外电路流向正极,电流和电子分析相反,据此来回答判断.
中发生电化学腐蚀,活泼金属作负极,不活泼金属作正极,负极发生氧化反应,正极发生还原反应,电子从负极经外电路流向正极,电流和电子分析相反,据此来回答判断.
解答: 解: 中发生化学腐蚀,b极有气体产生,c极无变化,所以金属的活动性顺序b>c;
中发生化学腐蚀,b极有气体产生,c极无变化,所以金属的活动性顺序b>c;
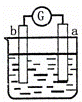 中发生电化学腐蚀,a极质量减小,b极质量增加,a极为负极,b极为正极,所以金属的活动性顺序a>b;
中发生电化学腐蚀,a极质量减小,b极质量增加,a极为负极,b极为正极,所以金属的活动性顺序a>b;
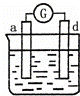 中发生电化学腐蚀,电流从a极流向d极,a极为正极,d极为负极,所以金属的活动性顺序d>a;
中发生电化学腐蚀,电流从a极流向d极,a极为正极,d极为负极,所以金属的活动性顺序d>a;
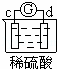 中发生电化学腐蚀,d极溶解,所以d是负极,c极有气体产生,所以c是正极,所以金属的活动性顺序d>c;
中发生电化学腐蚀,d极溶解,所以d是负极,c极有气体产生,所以c是正极,所以金属的活动性顺序d>c;
所以这四种金属的活动性顺序d>a>b>c,
故选:C.
点评: 本题主要考查了金属的活动性,掌握金属的腐蚀原理是解题的关键,难度不大.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
世界卫生组织(WHO)将二氧化氯ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用.下列说法正确的是( )
|
| A. | 二氧化氯是强氧化剂 | B. | 二氧化氯是强还原剂 |
|
| C. | 二氧化氯是离子化合物 | D. | 二氧化氯分子中氯为﹣1价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
由一氧化碳、甲烷和乙烷组成的混合气体8.96L(标准状况),在足量氧气中充分燃烧后,生成气体先通过足量浓硫酸,再通过足量氢氧化钠溶液,测知氢氧化钠溶液增重26.4g,则原混合气体中乙烷的物质的量为( )
|
| A. | 0.1 mol |
|
| B. | 大于或等于0.2 mol且小于0.3 mol |
|
| C. | 等于0.2 mol |
|
| D. | 大于0.1 mol且小于0.3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
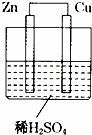
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )
实验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42﹣向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu﹣2e﹣═Cu2+,发生氧化反应.
A. ①②③ B. ②④ C. ②③④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
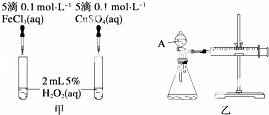
A. 图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C. 用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D. 为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,若在0.2L恒容密闭容器中,投入等物质的量的CO和Fe3O4,发生可逆反应:4CO+Fe3O4 4CO2+3Fe,至2min时容器内含有0.16mol CO2,以下有关描述正确的是( )
4CO2+3Fe,至2min时容器内含有0.16mol CO2,以下有关描述正确的是( )
①达平衡过程中,CO和Fe3O4的物质的量之比始终保持不变
②达平衡过程中,CO2和Fe的物质的量之比始终保持不变
③2min内,以CO表示该反应的化学反应速率为 0.4mol/(L•min)
④2min内,以Fe3O4表示该反应的化学反应速率为 0.1mol/(L•min)
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
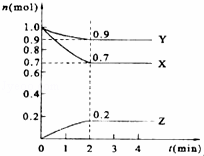
某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.
(1)由图中所给数据进行分析,该反应的化学方程式为 .
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为 .
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n始:n平= 10 .
(4)达到平衡时,X和Y的转化率之比,α(X):α(Y)= .
(5)平衡时,Z的体积分数为 (保留两位有效数字).
(6)反应达到平衡后,下列措施能加快化学反应速率的有 (填序号,多选或少选无分).
A.增大反应物的浓度 B.升高温度 C.使用正催化剂
(7)下列叙述能说明上述反应达到平衡状态的是 (填序号,多选或少选无分).
A.X、Y、Z的物质的量之比为3:1:2
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化
E.混合气体的总物质的量不随时间的变化而变.
查看答案和解析>>
科目:高中化学 来源: 题型:
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是( )
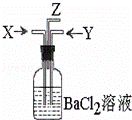
A. 洗气瓶中产生的沉淀是碳酸钡
B. Z导管出来的气体中含有二氧化碳
C. 气瓶中产生的沉淀是硫酸钡
D. Z导管口有红棕色气体出现
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.常温常压下,1.06g Na2 CO3含有的Na+离子数目为0.02 NA
CO3含有的Na+离子数目为0.02 NA
B.常温常压下,2NA 个CO2分子占有的体积为44.8L
C.标准状 况下,22.4LH2O含有的分子数为 NA
况下,22.4LH2O含有的分子数为 NA
D.物质的量浓度为0 .5mol/L的MgCl2溶液中,含有Cl- 个数为 NA
.5mol/L的MgCl2溶液中,含有Cl- 个数为 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com