
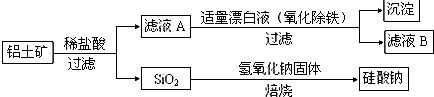


科目:高中化学 来源: 题型:
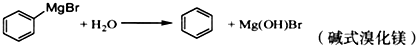
 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的合成流程如图1所示.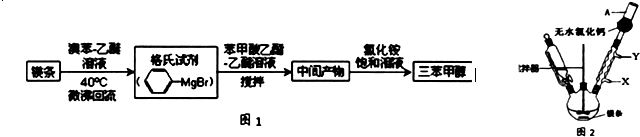
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸已酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,溶于乙醇、醚等多数有机溶剂 | |
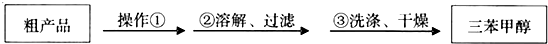
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、气体的平均分子量 |
| D、气体的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、平衡向逆反应方向移动 |
| B、a+b>c+d |
| C、Z的体积分数减小 |
| D、X的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、C=
| ||
B、已知常温下,氨水的电离常数为Ka,则pH约等于14+lg
| ||
| C、上述溶液中再加入0.5VmL同浓度稀盐酸,充分反应后c(Cl-)=c(NH4+)+c(NH3?H2O) | ||
| D、上述溶液中再加入VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
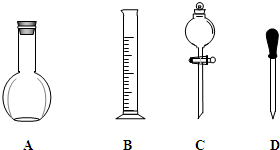 实验室需要0.1mol/L NaOH溶液 250mL.根据这种溶液的配制情况,回答下列问题.
实验室需要0.1mol/L NaOH溶液 250mL.根据这种溶液的配制情况,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com