
| A. | 右侧6处 | B. | 右侧6~7处 | C. | 右侧7处 | D. | 右侧7~8处 |
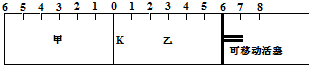
分析 根据题意可知,隔板K最终停留在左侧1处,说明反应后气体体积为5格,即物质的量为2.5mol,乙中2mol C相当于甲中的2mol A和1mol B,而乙中多了1mol He,反应2A(g)+B(g)?2C(g)是气体体积减小的反应,乙中参加反应的气体的分压小于甲容器,所以A、B、C三种气体的总量比甲中至少多1 mol,即大于3.5 mol,在乙容器中即使反应完全逆向进行,气体的物质的量最大不超过4mol,据此答题.
解答 解:根根据题意可知,隔板K最终停留在左侧1处,说明反应后气体体积为5格,即物质的量为2.5mol,乙中2mol C相当于甲中的2mol A和1mol B,而乙中多了1mol He,反应2A(g)+B(g)?2C(g)是气体体积减小的反应,乙中参加反应的气体的分压小于甲容器,所以A、B、C三种气体的总量比甲中至少多1 mol,即大于3.5 mol,在乙容器中即使反应完全逆向进行,气体的物质的量最大不超过4mol,所以乙中气体的物质的量为3.5 mol~4mol之间,故活塞停留在0刻度右侧6~7处,故选B.
点评 本题结合压强改变考查平衡的移动知识、判断到达平衡的标志及等效平衡的有关知识,本题注意分析反应的可逆性特征和两容器压强相等,这两个角度是解答该题的关键,题目难度中等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定不存在Ag+和NO3- | B. | 一定存在CO32- | ||
| C. | 一定存在NO3-和Cl- | D. | 一定不存在NO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 108g | B. | 54g | C. | 216g | D. | 64g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的平均反应速率为0.15mol/(L•min) | |
| B. | 恒温达平衡时,容器内压强为开始时的75% | |
| C. | B的转化率为20% | |
| D. | 平衡时A的浓度为0.75mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、N、O、H四种元素形成的化合物一定既有离子键,又有共价键 | |
| B. | 不同元素的原子构成的分子不一定只含极性共价键 | |
| C. | 含极性键的共价化合物一定是电解质 | |
| D. | HF的分子间作用力大于HCl,故HF比HCl更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| B. | 氢氧化亚铁溶于稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | 将铝片加入烧碱溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氯化铝溶液中加入过量氨水反应实质是Al3++4NH3•H2O═AlO2-+4NHO${\;}_{4}^{+}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com