
| W | X | Y | |
| Z |
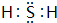 .
.
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2ZO3+4HI═Z↓+2I2+3H2O |
| ① | 还原性 | |
| ② | H2ZO3+2NaOH═Na2ZO3+2H2O |
分析 短周期元素X的最高化合价是+5,Y的单质可在空气中燃烧,由元素在周期表中相对位置可知,X为P元素、Y为S元素,W为Al,Z为Se.
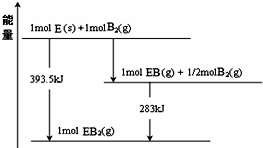
(1)主族元素周期数=电子层数、主族族序数=最外层电子数,Y元素氢化物为H2S,分子中S原子与H原子之间形成1对共用电子对;
(2)B元素与Y、Z同主族,且原子半径比二者小,则B为O元素;E是形成化合物种类最多的元素,则E为碳元素.
由图可知,1molC(s)与0.5molO2(g)反应得到1molCO(g)放出热量=393.5kJ-283kJ=110.5kJ,该反应热化学方程式为:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol ①
1molC(s)与1molO2(g)反应得到1molCO2(g)放出热量393.5kJ,该反应热化学方程式为:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ②,
根据盖斯定律,①×2-②得:CO2(g)+C(s)=2CO(g);
(3)25℃时,NaH2PO2溶液pH>7,向100mL 0.01mol•L-1的H3PO2溶液中,滴加等浓度的NaOH溶液至溶液呈中性,消耗氢氧化钠的物质的量小于H3PO2的物质的量;
(4)W的最高价氧化物为氧化铝,与氢氧化钠溶液反应生成偏铝酸钠与水;
100mL 1mol/L的AlCl3溶液中氯化铝的物质的量=0.1L×1mol/L=0.1mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.1mol×78g/mol=7.8g>3.9g,说明有两种情况:一为氢氧化钠体积较少,沉淀不完全,只生成Al(OH)3沉淀;另一种情况为氢氧化钠体积较多,沉淀完全后又部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算需要氢氧化钠溶液体积;
(5)H2SeO3与H2SO3相似,具有氧化性、还原性和酸性.
解答 解:短周期元素X的最高化合价是+5,Y的单质可在空气中燃烧,由元素在周期表中相对位置可知,X为P元素、Y为S元素,W为Al,Z为Se.
(1)Y为S元素,原子核外有3个电子层,最外层电子数为6,处于周期表中第三周期第ⅥA族,Y元素氢化物为H2S,分子中S原子与H原子之间形成1对共用电子对,其电子式为: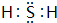 ,
,
故答案为:第三周期第ⅥA族;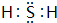 ;
;
(2)B元素与Y、Z同主族,且原子半径比二者小,则B为O元素;E是形成化合物种类最多的元素,则E为碳元素.
由图可知,1molC(s)与0.5molO2(g)反应得到1molCO(g)放出热量=393.5kJ-283kJ=110.5kJ,该反应热化学方程式为:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol ①
1molC(s)与1molO2(g)反应得到1molCO2(g)放出热量393.5kJ,该反应热化学方程式为:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ②,
根据盖斯定律,①×2-②得:CO2(g)+C(s)=2CO(g)△H=+172.5 kJ•mol -1,
故答案为:CO2(g)+C(s)=2CO(g)△H=+172.5 kJ•mol -1;
(3)25℃时,NaH2PO2溶液pH>7,向100mL 0.01mol•L-1的H3PO2溶液中,滴加等浓度的NaOH溶液至溶液呈中性,消耗氢氧化钠的物质的量小于H3PO2的物质的量,则消耗NaOH溶液的体积小于100mL,
故答案为:<;
(4)W的最高价氧化物为氧化铝,与氢氧化钠溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O,
100mL 1mol/L的AlCl3溶液中氯化铝的物质的量=0.1L×1mol/L=0.1mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.1mol×78g/mol=7.8g>3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
n(Al(OH)3)=$\frac{3.9g}{78g/mol}$=0.05mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,NaOH的物质的量为0.05mol×3=0.15mol,加入NaOH溶液的体积为$\frac{0.15mol}{1mol/L}$=0.15L=150mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.1mol 0.3mol 0.1mol
溶解的氢氧化铝为0.1mol-0.05mol=0.05mol,则:
Al(OH)3+OH-═AlO2-+2H2O
0.05mol 0.05mol
则消耗的碱的物质的量为0.3mol+0.05mol=0.35mol,
加入NaOH溶液的体积为$\frac{0.35mol}{1mol/L}$=0.035L=350mL;
故答案为:Al2O3+2OH-═2AlO2-+H2O;150或350;
(5)H2SeO3与H2SO3相似,具有氧化性、还原性和酸性,如反应:2H2SeO3+O2═2H2SeO4(或Br2+H2SeO3+H2O═H2SeO4+2HBr)中表现还原性,反应H2SeO3+2NaOH═Na2SeO3+2H2O表现酸性,
故答案为:
| 1 | 还原性 | 2H2SeO3+O2═2H2SeO4 (或Br2+H2SeO3+H2O═H2SeO4+2HBr) |
| 2 | 酸性 | H2SeO3+2NaOH═Na2SeO3+2H2O |
点评 本题与元素推断为载体,考查结构性质位置关系应用、热化学方程书写、化学方程式计算、元素周期律的应用等,(5)注意根据同主族元素化合物性质的相似性解答.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属元素与非金属元素形成的化学键一定是离子键 | |
| B. | ⅠA族和ⅦA族原子化合时,一定生成离子键 | |
| C. | 仅非金属元素形成的化合物中一定不是离子键 | |
| D. | 活泼金属与活泼非金属化合时,能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
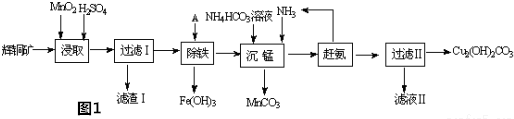

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4与C4H8一定是同系物 | |
| B. | 丙烯和乙烷都能使高锰酸钾酸性溶液褪色 | |
| C. | 1丁烯与2丁烯互为同分异构体 | |
| D. | 新戊烷和2,2二甲基丙烷互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
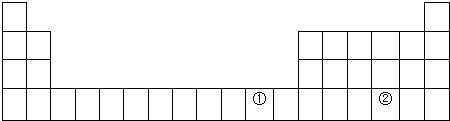
 .B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;
.B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | N60和N2是同素异形体 | B. | N60中氮原子之间由共价键结合 | ||
| C. | N60高温或撞击后应该生成N2 | D. | N60和14N都是氮的同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度 | B. | 加入大量的水 | ||
| C. | 加入适量盐酸 | D. | 加入适量烧碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
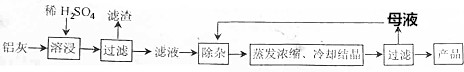
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com