
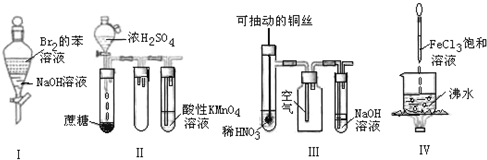


科目:高中化学 来源: 题型:
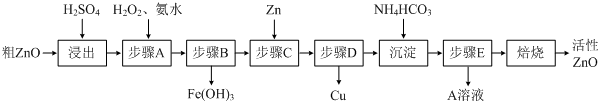
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
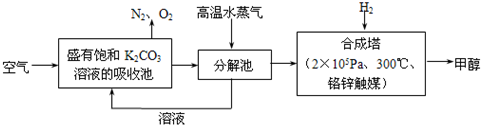
查看答案和解析>>
科目:高中化学 来源: 题型:
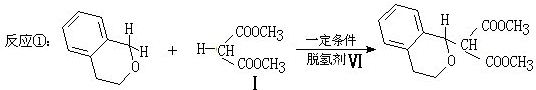





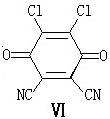 )分子获得2个氢原子后,转变成1个芳香族化合物分子,该芳香族化合物分子的结构简式为
)分子获得2个氢原子后,转变成1个芳香族化合物分子,该芳香族化合物分子的结构简式为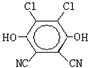

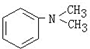 与1分子
与1分子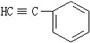 在一定条件下可发生类似①的反应,其产物分子的结构简式为
在一定条件下可发生类似①的反应,其产物分子的结构简式为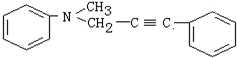
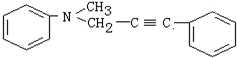
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?广东)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图所示.
(2011?广东)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com