
| A. | 3:1 | B. | 1:1 | C. | 2:1 | D. | 1:3 |
分析 Al分别与足量稀盐酸、NaOH溶液反应生成相同条件下的同体积氢气,Al和稀盐酸、NaOH溶液反应方程式分别为2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据方程式计算.
解答 解:Al和稀盐酸、NaOH溶液反应方程式分别为2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Al与足量稀盐酸、NaOH溶液反应时生成相同条件下的同体积氢气,说明生成氢气的物质的量相等,假设都是生成3mol氢气,消耗稀盐酸6mol、消耗NaOH溶液2mol,所以反应中消耗的HCl和NaOH的物质的量之比=6mol:2mol=3:1,故选A.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,正确书写方程式是解本题关键,题目难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应速率:乙>甲 | B. | 平衡时C的体积分数:乙>甲 | ||
| C. | 平衡时C的转化率:乙>甲 | D. | 平衡时A的物质的量:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯分子中含有C═C键的数目为3NA | |
| B. | 含1molNa2CO3的溶液中,阴离子总数大于NA | |
| C. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| D. | 标准状况下,22.4L空气中含有的氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 4N2(g)+6H2O(g);△H
4N2(g)+6H2O(g);△H| 反应 | △H(kJ•mol-1) | 平衡常数(K) |
| 4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g) | -905.5 | 1.1×1026mol•L-1 |
| 4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g) | -1104.9 | 4.4×1028 |
| 4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g) | -1269.0 | 7.1×1034L•mol-1 |
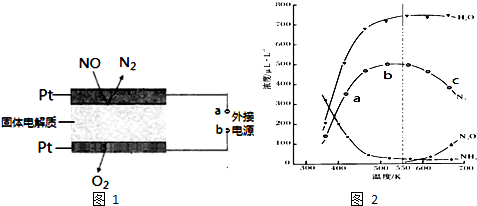
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+)=10-13mol/L的溶液中可能存在:HCO3-、K+、Cl- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、I- | |
| C. | pH=l的溶液中的溶液中可以大量存在:K+、I-、NO3- | |
| D. | NH4Fe(SO4)2的溶液中一定可以存在:H+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
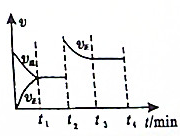
| A. | t2可能是升高温度 | |
| B. | t1时刻Y的体积分数可能比t3时刻Y的体积分数小 | |
| C. | t1时刻X的浓度可能比t3时刻X的浓度大 | |
| D. | t1时的平衡是从逆反应方向建立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| a | b | |||
| c | d |
| A. | a的氢化物水溶液显酸性 | |
| B. | 在这4种元素中,b的氢化物热稳定性最好 | |
| C. | c的氧化物是碱性氧化物 | |
| D. | d的氧化物对应水化物一定是强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com