
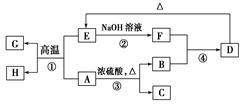
 Si(粗)+2CO↑ SiO2+2OH-=SiO32-+H2O
Si(粗)+2CO↑ SiO2+2OH-=SiO32-+H2O Si(粗)+2CO↑,石英的主要成分是SiO2,与烧碱反应制取水玻璃,反应的离子方程式为SiO2+2OH-=SiO32-+H2O。
Si(粗)+2CO↑,石英的主要成分是SiO2,与烧碱反应制取水玻璃,反应的离子方程式为SiO2+2OH-=SiO32-+H2O。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.n(烧碱)<n(稀硝酸)<n(盐酸) |
| B.n(烧碱)<n(盐酸)<n(稀硝酸) |
| C.n(稀硝酸)<n(烧碱)<n(盐酸) |
| D.n(盐酸)<n(稀硝酸)<n(烧碱) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硅酸钠可用于制备木材防火剂 | B.硅单质广泛用于光纤通讯 |
| C.利用盐酸刻蚀石英制作艺术品 | D.水晶项链是硅酸盐制品 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.沙子、石英、水晶的主要成分都是SiO2 |
| B.SiO2是制光导纤维的主要原料 |
| C.硅酸可由SiO2直接制得 |
| D.SiO2是酸性氧化物,一定条件下可与碱性氧化物或碱反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.石英沙、水晶的主要成分都是SiO2 |
| B.SiO2是制光导纤维的主要原料 |
| C.石灰石是制普通玻璃、水泥的原料之一 |
| D.SiO2与水反应直接制得硅酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com