
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为一放热反应。现将2 mol SO2、1 mol O2充入一密闭容器中充分反应后,放出热量98.3 kJ,此时测得SO2的物质的量为1 mol。则下列热化学方程式正确的是( )
| A.2SO2(g)+O2(g)?==?2SO3(g) ΔH=-196.6 kJ·mol-1 |
| B.2SO2(g)+O2(g)?==?2SO3(g) ΔH=-98.3 kJ·mol-1 |
C.SO2(g)+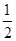 O2(g)?==?SO3(g) ΔH=+98.3 kJ·mol-1 O2(g)?==?SO3(g) ΔH=+98.3 kJ·mol-1 |
D.SO2(g)+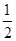 O2(g) ="=" SO3(g) ΔH=+196.6 kJ·mol-1 O2(g) ="=" SO3(g) ΔH=+196.6 kJ·mol-1 |
A
解析试题分析:根据放热反应中ΔH<0,所以C、D错误。因为生成1 mol SO3(g)时放出98.3kJ的热量,所以生成2mol SO3(g)时放出热量为196.6kJ,ΔH的单位一般为kJ·mol-1(kJ/mol),所以A正确。
考点:热化学方程式的书写正误判断
点评:反应热ΔH只能写在标有反应物和生成物状态的化学方程式的右边。ΔH为“-”表示放热反应,ΔH为“+”表示吸热反应。ΔH的单位一般为kJ·mol-1(kJ/mol)。热化学方程式是表示反应已完成的数量。由于ΔH与反应完成物质的量有关,所以方程式中化学前面的化学计量系数必须与ΔH相对应,如果化学计量系数加倍,那么ΔH也加倍。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c2(SO3) |
| c2(SO2)c(O2) |
| c2(SO3) |
| c2(SO2)c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-98.3 kJ·mol-1
2SO3(g);ΔH=-98.3 kJ·mol-1
B.SO2(g)+![]() O2(g)
O2(g)![]() SO3(g);ΔH=+98.3 kJ·mol-1
SO3(g);ΔH=+98.3 kJ·mol-1
C.SO2(g)+ ![]() O2(g)
O2(g)![]() SO3(g);ΔH=-196.6 kJ·mol-1
SO3(g);ΔH=-196.6 kJ·mol-1
D.2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-196.6 kJ·mol-1
2SO3(g);ΔH=-196.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com