
| A. | Na+0.6mol/L | B. | CO32- 0.2 mol/L | C. | Mg2+0.4 mol/L | D. | Ba2+0.4mol/L |
分析 根据溶液中电荷守恒判断M离子的电性,c(Cl-)+2c(SO42-)=0.4mol/L+2×0.8mol/L=2mol/L,3c(Al3+)+c(H+)=3×0.2mol/L+0.6mol/L=1.2mol/L,所以M为阳离子,设M阳离子为c(Mn+),根据电荷守恒有nc(Mn+)=2mol/L-1.2mol/L=0.8mol/L,再结合选项考进行判断.
解答 解:溶液中总负电荷浓度为:c(Cl-)+2c(SO42-)=0.4mol/L+2×0.8mol/L=2mol/L,总电荷浓度为:3c(Al3+)+c(H+)=3×0.2mol/L+0.6mol/L=1.2mol/L,
所以M为阳离子,设M阳离子为c(Mn+),根据电荷守恒有:nc(Mn+)=2mol/L-1.2mol/L=0.8mol/L,
A.1×c(Na+)=0.6mol/L,故A错误;
B.由上述分析可知,M为阳离子,不可能是CO32-,故B错误;
C.2×c(Mg2+)=2×0.4 mol/L=0.8mol/L,故C正确;
D.2×c(Ba2+)=2×0.4mol/L=0.8mol/L,但硫酸根离子与钡离子不能共存,故D错误;
故选C.
点评 本题考查学生利用溶液不显电性进行物质的量浓度计算、结合计算、离子共存判断溶液中离子,题目难度中等,注意掌握电荷守恒在化学计算中的应用方法,D选项为易错点,容易忽略离子的共存.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | 向氯化铁溶液中加入NaOH溶液,可制得Fe(OH)3胶体 | |
| C. | 固体的NaCl不导电,熔融态的NaCl可以导电 | |
| D. | 在河流入海口处易形成三角洲原理与胶体的性质无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钾和氧化汞都属于氧化物 | B. | 氧气和臭氧都属于单质 | ||
| C. | 碳酸钙和甲烷都属于有机物 | D. | 火碱和纯碱都属于碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1Na3PO4溶液 | B. | 75 mL 2 mol•L-1NaNO3溶液 | ||
| C. | 75 mL 3 mol•L-1Na2SO4溶液 | D. | 150 mL 2mol•L-1 CH3COONa溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ | |
| B. | 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ | |
| C. | 反应①的产物比反应②的产物稳定 | |
| D. | 物质的量相同时,反应②的反应物总能量比反应①的反应物总能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Ⅰ有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.A元素的原子是半径最小的原子,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:
Ⅰ有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.A元素的原子是半径最小的原子,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题: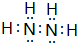 .将N2H4和O2通入到由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为N2H4-4e-+4OH-=N2↑+4H2O.
.将N2H4和O2通入到由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为N2H4-4e-+4OH-=N2↑+4H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
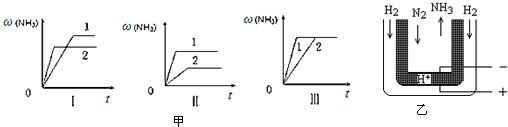
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com