
【题目】下列实验设计及其对应的离子方程式均正确的是( )
A. 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+
B. Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑
C. 将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO-
D. 明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+
科目:高中化学 来源: 题型:
【题目】已知钠、铁都能与水反应,下列叙述不正确的是( )
A.它们反应的难易程度不同B.它们反应的产物不完全相同
C.都需在高温条件下进行D.反应类型都是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p轨道的电子数等于次外层的电子总数,B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。根据以上条件,回答下列问题:
(1)画出C的原子结构示意图:________。
(2)写出D原子的外围电子排布式:________。
(3)写出A元素单质在B中完全燃烧的化学方程式:______________。
(4)指出E元素在元素周期表中的位置:____________。
(5)比较A、B、C三种元素的第一电离能的大小顺序:________________(按由大到小的顺序排列,用元素符号表示)。
(6)比较元素D和E的电负性的相对大小:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL NaOH溶液中通入一定量的CO2后,在继续向该溶液中逐滴加入0.2 mol·L-1的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示
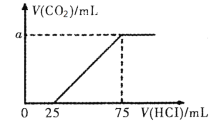
下列有关说法不正确的是
A.原溶液中NaOH的物质的量浓度为0.15 mol·L-1
B.0~25 mL发生的离子反应为:OH-+ H+ =H2O
C.通入CO2后所得的溶液中溶质的物质的量之比为1:1
D.纵坐标中a的数值为224
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 现有下列十种物质:
①液态HCl ②NaHCO3 ③熔融NaCl ④CO2 ⑤蔗糖晶体 ⑥Ba(OH)2溶液 ⑦氢氧化铁胶体 ⑧氨水 ⑨空气 ⑩NaHSO4
(1)上述十种物质中属于电解质的有_______________(填序号)。
(2)⑩在水溶液中的电离方程式为__________________________________。
II.青海昆仑玉被定为十年前北京奥运会奖牌用玉,昆仑玉主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,透闪石(Tremolite)的化学成分为Ca2Mg5Si8O22(OH)2。透闪石的化学式写成氧化物的形式为__________________________。
III.实验室需要用质量分数为98%、密度为1.84g/cm3的浓硫酸配制1.0 mol·L-1的稀硫酸溶液450mL,请回答下列问题
(1)需要用量筒量取的浓硫酸的体积为____________ mL。
(2)下面操作造成所配稀硫酸溶液浓度(填“偏高”、“偏低”或“无影响”)
①用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶_______________。
②向容量瓶加水定容时眼睛俯视液面_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,此装置可用来制取和观察Fe(OH)2在空气中被被氧化的颜色变化。实验时必须使用铁屑和6molL-1的硫酸,其他试剂任选。填写下列空白:

(1)B中盛有一定量的NaOH溶液,A中应预先加入的药品是__。A中反应的离子方程式是__。
(2)实验开始时先将活塞a__(填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程:__。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为__。
(5)下列各图示中,___能较长时间看到Fe(OH)2白色沉淀。(填序号)
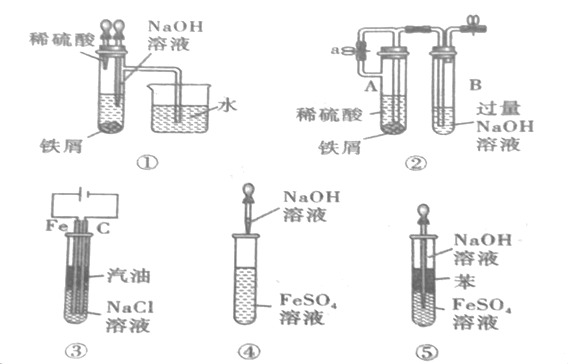
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 硫酸铝溶液中滴加过量浓氨水:Al3+ + 4OH- = AlO![]() + 2H2O
+ 2H2O
B. NaHCO3溶液水解:HCO![]() + H2O = H2CO3 + OH-
+ H2O = H2CO3 + OH-
C. 浓氢氧化钠溶液吸收少量SO2气体:SO2+ 2OH- = SO![]() + H2O
+ H2O
D. 向小苏打溶液中加入醋酸溶液:HCO![]() + H+= CO2↑+ H2O
+ H+= CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是
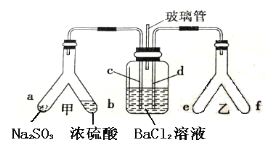
A. e、f两管中的试剂可以分别是浓氨水和NaOH固体
B. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的化合物在生产、生活中有着重要的作用。
(1)已知:2CO(g)+O2(g)![]() 2CO2(g) △H1=-566kJ·molˉ1
2CO2(g) △H1=-566kJ·molˉ1
H2O(g)+CO(g)![]() H2(g)+CO2(g) △H2=-41kJ·molˉ1
H2(g)+CO2(g) △H2=-41kJ·molˉ1
CO(g)+2H2(g)![]() CH3OH(g) △H3=-107kJ·molˉ1
CH3OH(g) △H3=-107kJ·molˉ1
则CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) △H=___kJ·molˉ1
CO2(g)+2H2O(g) △H=___kJ·molˉ1
(2)T℃时,向容积均为2L的A、B两个密闭容器中均通入4.0molCO2和6.8molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。
CH3OH(g)+H2O(g) △H=-50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率 α (CO2) 随时间的变化如图所示。
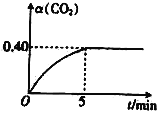
①在0~5min内A容器中v(CH3OH)=___;该温度下上述反应的平衡常数K=___(保留两位有效数字)。
②反应开始至平衡的过程中,A、B两容器中CO2的消耗速率的大小关系为v(A)___(填“>”“<”或“=”)v(B)。
③反应过程中,下列各项指标能表明A容器中反应的v正>v逆的是___(填标号)
a.体系内的压强增大
b.气体的平均相对分子质量增大
c.断裂H-H键的数目是形成C-O键数目的2倍
d.v逆(CO2)=v正(H2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com