
| A. | X氢化物溶于水后,在常温下,该溶液的pH<7 | |
| B. | Y的最高价氧化物的水化物具有两性 | |
| C. | Z离子在水溶液中水解导致其溶液显碱性 | |
| D. | 简单离子的半径:Y>Z>X |
分析 短周期元素X、Y、Z的原子序数依次递增,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍,也是Y原子最外层电子数的3倍,最外层电子数不超过8个,K层不超过2个,则X内层电子数是2,所以X位于第二周期,Y、Z位于第三周期,则Z为S元素,Y最外层电子数为2,且处于第三周期,为Mg元素,这三种元素原子的最外层电子数之和为13,Y、Z最外层电子数之和为8,所以X最外层电子数为5,故X为N元素,以此解答该题.
解答 解:短周期元素X、Y、Z的原子序数依次递增,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍,也是Y原子最外层电子数的3倍,最外层电子数不超过8个,K层不超过2个,则X内层电子数是2,所以X位于第二周期,Y、Z位于第三周期,则Z为S元素,Y最外层电子数为2,且处于第三周期,为Mg元素,这三种元素原子的最外层电子数之和为13,Y、Z最外层电子数之和为8,所以X最外层电子数为5,故X为N元素,
A.X为N元素,对应的氢化物为氨气,水溶液呈碱性,故A错误;
B.Y为Mg元素,最高价氧化物的水化物呈碱性,故B错误;
C.S对应的简单离子可水解生成氢氧根离子,溶液呈碱性,故C正确;
D.核外电子排布相同的离子,核电荷数越大离子半径越小,故D错误.
故选C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,需要学生熟练掌握核外电子排布,侧重考查分析、推断能力,难度不大.


 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:解答题
 喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.
喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二甲苯和四甲苯均有三种 | |
| B. | 乙醇的酯化反应和酯的水解均属于取代反应 | |
| C. | 乙醇、乙酸均可与金属钠反应 | |
| D. | 石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
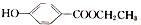 )是一种常用的食品添加剂,合成路线如下:
)是一种常用的食品添加剂,合成路线如下: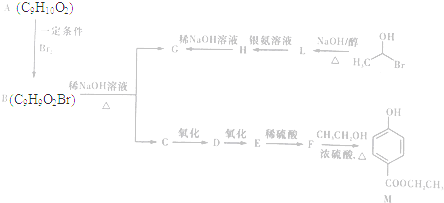
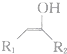 $\stackrel{不稳定、自动转化}{→}$
$\stackrel{不稳定、自动转化}{→}$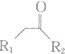 (R1、R2为H或烃基)
(R1、R2为H或烃基) 与稀氢氧化钠溶液不反应
与稀氢氧化钠溶液不反应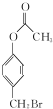 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$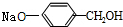 +CH3COONa+H2O+NaBr;
+CH3COONa+H2O+NaBr;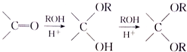 由乙烯、甲醇为有机原料制备化合物
由乙烯、甲醇为有机原料制备化合物 的合成路线流程图(无机试剂任选)如下:
的合成路线流程图(无机试剂任选)如下: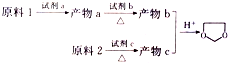
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
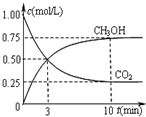 工业上可以以煤和水为原料通过一系列转化变为清洁能源氢气或工业原料甲醇.
工业上可以以煤和水为原料通过一系列转化变为清洁能源氢气或工业原料甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com