

| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol•L-1 | 0.64 | 0.50 | 0.50 |
分析 (1)根据盖斯定律计算△H;平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
(2)反应前后气体的气体减小,增大压强平衡向体积减小的方向移动;
(3)反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动;
(4)由图表可知,在较低温时,反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,反应体系均已达到平衡,随着温度的升高平衡向逆反应方向移动,CO的转化率减小;
(5)①将各物质的浓度带入平衡常数表达式,将计算结果与平衡常数进行比较,从而判断平衡移动方向;
②若开始只加入CH3OH,经10min后反应达到平衡,假设开始加入的甲醇为1mol,设转化的甲醇为xmol,表示出平衡时各组分物质的量,反应前后气体物质的量不变,可以用物质的量代替浓度计算平衡常数,根据平衡常数列方程计算解答.
解答 解:(1)已知①2H2(g)+CO(g)???CH3OH(g)△H=a kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=b kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=c kJ•mol-1
根据盖斯定律,①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=(2a+b+c)kJ•mol-1,
平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,所以K=$\frac{c(C{H}_{3}OC{H}_{3})c(C{O}_{2})}{{c}^{3}(CO){c}^{3}({H}_{2})}$;
故答案为:(2a+b+c)kJ•mol-1;$\frac{c(C{H}_{3}OC{H}_{3})c(C{O}_{2})}{{c}^{3}(CO){c}^{3}({H}_{2})}$;
(2)反应前后气体的气体减小,增大压强平衡向体积减小的方向移动,即向正反应方向移动,CH30CH3的产率增大;
故答案为:增大;
(3)反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率,
故答案为:反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率;
(4)由图表可知,温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小,
在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小,
故答案为:温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小;
在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小;
(5)①该反应的平衡常数表达式为:K=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$,将所给浓度带入平衡常数表达式:$\frac{0.5×0.5}{0.4{4}^{2}}$=1.29<400,故反应向正反应方向进行,正反应速率大于逆反应速率;
故答案为:>;
②若开始只加入CH3OH,经10min后反应达到平衡,假设开始加入的甲醇为1mol,设转化的甲醇为xmol,则:
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始量(mol):1 0 0
变化量(mol):x 0.5x 0.5x
平衡量(mol):1-x 0.5x 0.5x
反应前后气体物质的量不变,可以用物质的量代替浓度计算平衡常数,则$\frac{0.5x×0.5x}{(1-x)2}$=400mol,解得x=0.975,故甲醇的转化率为$\frac{0.975}{1}$×100%=97.5%;
故答案为:97.5%.
点评 本题考查盖斯定律、化学平衡计算、平衡常数应用、注意理解掌握平衡常数的应用,本题较为综合,题量较大,注意“始、转、平”是解决有关化学平衡的“三段论”解题法,难度中等.


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现用18mol/L的浓H2SO4来配制100mL 3.6mol/L的稀硫酸.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平.请回答下列问题:
现用18mol/L的浓H2SO4来配制100mL 3.6mol/L的稀硫酸.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用丁达尔效应分离Fe(OH)3胶体和FeCl3溶液 | |
| B. | Fe(OH)3胶体的胶粒带正电荷,通电时胶粒向直流电源的负极移动,这种现象称为电泳 | |
| C. | 向沸腾蒸馏水逐滴加饱和FeCl3溶液,至液体呈透明红褐色时即得到Fe(OH)3胶体 | |
| D. | 向沸腾的NaOH稀溶液中边滴加FeCl3饱和溶液,边用玻璃棒搅动,然后继续煮沸,制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
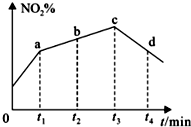 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下液氨中c(NH4+)•c(NH2-)是一个常数 | |
| B. | 液氨中含有NH3、NH4+、NH2-等粒子 | |
| C. | 只要不加入其他物质,液氨中c(NH4+)=c(NH2-) | |
| D. | 液氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com