
| A. | v(A)=0.3mol/(L•s) | B. | v(B)=0.6mol/(L•s) | C. | v(C)=0.4mol/(L•s) | D. | v(D)=0.45mol/(L•s) |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
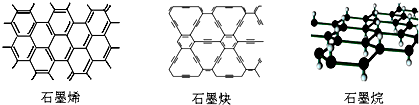
| A. | 石墨烯和石墨炔互为同素异形体 | |
| B. | 石墨炔有望替代二氧化硅用作半导体材料 | |
| C. | 12g石墨烯完全转变为石墨烷需标况下11.2L氢气 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气 | B. | 氦气 | C. | 氧气 | D. | 二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 mol Fe与足量稀HNO3反应,转移电子的数目为2 NA | |
| B. | 18 g D2O中含有的质子数目为10 NA | |
| C. | 标准状况下,22.4 L二氯甲烷的分子数约为NA | |
| D. | 28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
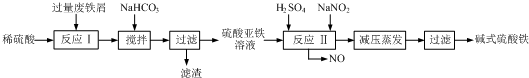
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
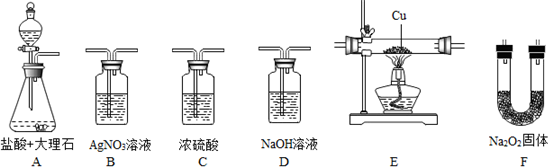
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是
,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
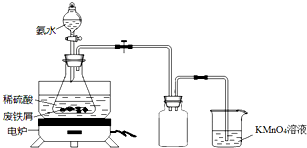 某实验小组用废铁屑(含少量S等元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体[K3Fe(C2O4)3•3H2O]并测定其组成.
某实验小组用废铁屑(含少量S等元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体[K3Fe(C2O4)3•3H2O]并测定其组成.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com