
碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
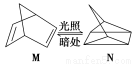 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+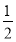 O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式: 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-2练习卷(解析版) 题型:填空题
已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为 。
a.大于7 b.等于7 c.小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mol/L,B溶液中水电离出的氢离子浓度为 mol/L。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-2练习卷(解析版) 题型:填空题
一定条件下,体积为1 L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)  SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
(1)下列各项中能说明该反应已达化学平衡状态的是________(填字母序号)。
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
反应时间/min | n(SiF4)/mol | n(H2O)/mol |
0 | 1.20 | 2.40 |
t1 | 0.80 | a |
t2 | b | 1.60 |
通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:________。
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应________(填序号)。
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-1练习卷(解析版) 题型:选择题
在密闭容器中进行反应CH4(g)+H2O(g)  CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是( )
CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是( )
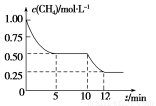
A.10 min时,改变的外界条件可能是升高温度
B.0~10 min内,v(H2)=0.15 mol·L-1·min-1
C.恒温下,缩小容器体积,一段时间内v(逆)>v(正)
D.12 min时,反应达平衡的本质原因是气体总质量不再变化
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-1练习卷(解析版) 题型:选择题
一定温度下反应4A(s)+3B(g)  2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1,对此反应速率的表示正确的是( )
2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1,对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是1∶2∶3
C.2 min末的反应速率v(B)=0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值都是逐渐减小的
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练6-1练习卷(解析版) 题型:选择题
下列有关热化学方程式及其叙述正确的是( )
A.氢气的燃烧热为285.5 kJ·mol·-1,则水分解的热化学方程式为:2H2O(l)=2H2+O2(g)ΔH=+285.5 kJ·mol-1
B.已知2C(石墨,s)+O2(g)=2CO(g)ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C.已知N2(g)+3H2(g)  2NH3(g)ΔH=-92.4 kJ·mol-1,
2NH3(g)ΔH=-92.4 kJ·mol-1,
则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后最多可放出92.4 kJ的热量
D.已知乙醇和乙烯的燃烧热分别为1 366.8 kJ·mol-1和1 411.0 kJ·mol-1,则乙烯水化制乙醇的热化学方程式为:C2H4(g)+H2O(l)=C2H5OH(l) ΔH=-44.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-3练习卷(解析版) 题型:填空题
已知X元素原子的K、L层的电子数之和比L、M层的电子数之和多1个电子。Y元
素的原子最外层电子数比内层电子数少3个。Z元素核外有3个电子层,最外层有3个电子。W元素最高化合价是最低化合价绝对值的3倍,它在最高价氧化物中的质量分数为40%。
(1)Y和W的气态氢化物的稳定性为(用化学式表示) > 。
(2)X单质在空气中加热生成的化合物是 化合物(填“离子”或“共价”)。
(3)X和Z的最高价氧化物对应水化物反应的离子方程式 。
(4)W的低价氧化物与Y单质的水溶液反应的化学方程式 。
(5)Y与Z形成化合物的化学式是 。实验测得当此化合物处于固态和液态时不导电,溶于水能导电。由此判断该化合物具有 键(填“离子”或“共价”)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-2练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.P和S属于第三周期元素,P原子半径比S小
B.同周期ⅡA和ⅢA族元素的原子序数都相差1
C.短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则原子序数、原子半径和单质的还原性都按照A、B、C、D的顺序减小
D.Cl和Br属于第ⅦA族元素,HClO4酸性比HBrO4强。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练4-3练习卷(解析版) 题型:填空题
浓硫酸具有以下A~F的性质:A酸性;B高沸点难挥发;C吸水性;D脱水性;E强氧化性;F溶于水放出大量热
(1)浓硫酸与铜共热发生反应的化学方程式为 。实验中往往有大量蓝色固体析出,可见浓硫酸在该实验中表现的性质有 。(浓硫酸性质用“A”、“B”、“C”、“D”、“E”、“F”填空,下同)
(2)实验证明铜不能在低温下与O2反应,也不能与稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并通入空气来制备CuSO4溶液。铜屑在此状态下被溶解的化学方程式为 。硫酸在该反应中表现的性质是 。
(3)在过氧化氢与稀硫酸的混合溶液中加入铜片,常温下就生成蓝色溶液。写出有关反应的化学方程式: 。与(2)中反应比较,反应条件不同的原因是 。
(4)向蔗糖晶体中滴2~3滴水,再滴入适量的浓硫酸。发现加水处立即变黑,黑色区不断扩大,最后变成一块疏松的焦炭,并伴有刺激性气味的气体产生。写出产生有刺激气味气体的化学方程式: 。该实验中浓硫酸表现的性质有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com