
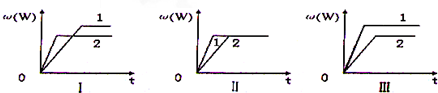
| A�� | ͼI�����Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��p2��p1��a+b��n | |
| B�� | ͼI�����Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T2��T1����H��0 | |
| C�� | ͼII�����Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��p1��p2��n=a+b | |
| D�� | ͼ������Dz�ͬ�¶ȶԷ�ӦӰ�죬��T1��T2����H��0 |
���� A�����ͼI�Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬���ݡ��ȹ���ƽ��ֵ��֪��P2��P1������ѹǿ��ƽ�������������С�ķ����ƶ���
B�����ͼ�����¶ȶԷ�Ӧ��Ӱ�죬���ݡ��ȹ���ƽ��ֵ��֪��T2��T1�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ���
C�����ͼII�Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬���ݡ��ȹ���ƽ��ֵ��֪P1��P2���������ʵĺ����ж������������
D�����ͼIII�Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬���ݡ��ȹ���ƽ��ֵ��֪��T1��T2�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ���
��� �⣺A�����ͼI�Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬���ݡ��ȹ���ƽ��ֵ��֪��P2��P1������ѹǿ��ƽ�������������С�ķ����ƶ���ƽ�����淴Ӧ�����ƶ�����a��n����A����
B�����ͼ�����¶ȶԷ�Ӧ��Ӱ�죬���ݡ��ȹ���ƽ��ֵ��֪��T2��T1�������¶ȣ���������Ϊ���ȷ�Ӧ����w�ķ�����������ͼ��ì�ܣ���B����
C�����ͼII�Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬���ݡ��ȹ���ƽ��ֵ��֪P1��P2������ѹǿ��ƽ�ⲻ�ƶ���˵����Ӧǰ�����������֮�Ͳ��䣬��a+b=n����C��ȷ��
D�����ͼIII�Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬���ݡ��ȹ���ƽ��ֵ��֪��T1��T2�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ���ƽ��������Ӧ�����ƶ���������Ӧ�����ȷ�Ӧ����H��0����D����
��ѡ��C��
���� ���⿼����������Է�Ӧ���ʡ���ѧƽ���Ӱ��ͼ���������ȷͼƬ�����߱仯���ơ����߹յ�������֪ʶ�㼴�ɽ�𣬶���ͼ��������á��ȹ���ƽ��ֵ������һ�������ķ��������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��1����2����3����4����5�� | B�� | ��4����5����7���� | C�� | ��4����5�� | D�� | ��3����4����5����7�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
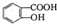 ������NaHC03��Һ��Ӧ�Ʊ�
������NaHC03��Һ��Ӧ�Ʊ�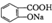
| A�� | ֻ�Т٢ۢ� | B�� | ֻ�Т٢� | C�� | ֻ�Т� | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
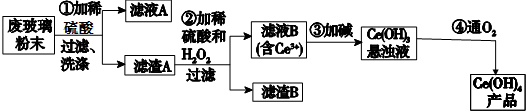
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 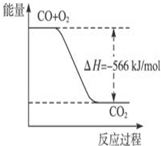 ͼ�ɱ�ʾ��CO����CO2�ķ�Ӧ���̺�������ϵ | |
| B�� | CO��ȼ����Ϊ566 kJ/mol | |
| C�� | Na2O2��s��+CO2��s��=Na2CO3��s��+$\frac{1}{2}$O2��g����H=-226 kJ/mol | |
| D�� | CO��g����Na2O2��s����Ӧ�ų�509 kJ����ʱ������ת����Ϊ2��6.02��1023 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
 �����£�����ͼ��ʾ��װ�ý��е�⣮ͨ��һ���������ʪ��ĵ���KI��ֽ��C�˱�Ϊ��ɫ����������ʱ��A��Bװ���й��ռ�������1.68L����״���������������������������Ӧ���������ⶨ����A����Һ���ǡΪ1000mL�����ʱA��Һ��pHֵ������ʾ��pH=-lgc��H+����
�����£�����ͼ��ʾ��װ�ý��е�⣮ͨ��һ���������ʪ��ĵ���KI��ֽ��C�˱�Ϊ��ɫ����������ʱ��A��Bװ���й��ռ�������1.68L����״���������������������������Ӧ���������ⶨ����A����Һ���ǡΪ1000mL�����ʱA��Һ��pHֵ������ʾ��pH=-lgc��H+�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ۢݢ� | B�� | �ڢܢݢ� | C�� | �ڢܢ� | D�� | �ڢۢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H3=��H1+��H2 | B�� | ��H3=��H1+2��H2 | C�� | ��H3=2��H2-��H1 | D�� | ��H3=��H1-��H2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com