
【题目】某化学小组用50ml 0.50mol/L NaOH溶液和30ml 0.50mol/L硫酸溶液进行中和热的测定实验。
(1)实验中大约要使用230mL NaOH溶液,配制溶液时至少需要称量NaOH固体__ g。
(2)做中和热的测定实验时:桌上备有大、小两个烧杯、泡沫塑料、硬纸板、胶头滴管、环形玻璃搅拌棒.实验尚缺少的玻璃仪器(用品)是______、______。
(3)他们记录的实验数据如下:
①请填写表中的空白:
实验次数 | 起始温度t1 | 终止温度t2/℃ | 温度差平均值(t2﹣t1)/℃ | |
H2SO4 | NaOH | |||
1 | 25.0℃ | 25.0℃ | 29.1 | Δt=________ |
2 | 25.0℃ | 25.0℃ | 29.8 | |
3 | 25.0℃ | 25.0℃ | 28.9 | |
4 | 25.0℃ | 25.0℃ | 29.0 | |
②已知:溶液的比热容c为4.18 J·℃-1·g-1,溶液的密度均为1 g·cm-3。写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式____________(用该实验的数据,取小数点后一位)。
(4)若用氨水代替NaOH做实验,测定结果ΔH会___(填“偏大”、“偏大”、“无影响”)。
【答案】5.0 量筒 温度计 4.0 ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l)△H=﹣53.5kJ/mol 偏大
Na2SO4(aq)+H2O(l)△H=﹣53.5kJ/mol 偏大
【解析】
(1) 配制230mL NaOH溶液,需要选用250mL的容量瓶;
(2)缺少量取溶液体积的量筒、测量温度的温度计;
(3) ①4次实验温度的差值分别为4.1℃、4.8℃、3.9℃、4.0℃,第二次数据差距较大,舍弃数据;
②根据Q=c![]() m
m![]() t、
t、![]() H=- Q/n进行计算;
H=- Q/n进行计算;
(4)若用氨水代替NaOH做实验,氨水为弱碱,电离时吸收热量。
(1) 配制230mL NaOH溶液,需要选用250mL的容量瓶,m(NaOH)=0.50mol/L![]() 0.25L
0.25L![]() 40g/mol=5.0g;
40g/mol=5.0g;
(2)缺少量取溶液体积的量筒、测量温度的温度计;
(3) ①4次实验温度的差值分别为4.1℃、4.8℃、3.9℃、4.0℃,第二次数据差距较大,舍弃数据,则3次数据的平均值为(4.1+3.9+4.0)/3=4.0℃;
②Q=c![]() m
m![]() t=4.18
t=4.18![]() 80
80![]() 4.0=1337.6J,中和反应为放热反应,则
4.0=1337.6J,中和反应为放热反应,则![]() H=- Q/n=-1.3376kJ/0.025mol=-53.5kJ/mol;
H=- Q/n=-1.3376kJ/0.025mol=-53.5kJ/mol;
(4)若用氨水代替NaOH做实验,氨水为弱碱,电离时吸收热量,导致中和时释放的热量减少,焓变偏大。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I.橙红色化合物A由五种元素组成,其中一种元素为原子半径最大的短周期元素(稀有气体元素除外),按如图流程进行实验。气体B为纯净物,能使湿润的红色石蕊试纸变蓝,溶液C呈黄色,沉淀D为砖红色沉淀。
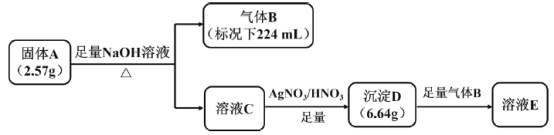
请回答:
(1)组成A的金属元素是___________(填元素符号),A的化学式是___________。
(2)沉淀D与足量B反应的离子反应方程式____________。
(3)A中的某种金属元素对应的单质可以通过铝热反应制备,写出化学反应方程式________。
II.某兴趣小组为了探究84消毒液(主要成分NaClO)和酒精混合使用是否存在安全隐患,利用如图装置进行实验。
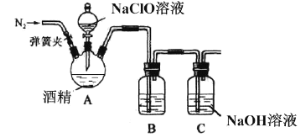
请回答:
(1)三颈烧瓶中出现黄绿色气体,请写出相应的化学方程式__________。(乙醇被氧化为乙醛)
(2)有同学用手触碰三颈烧瓶后发现,反应一段时间后装置温度升高,所以提出产生的气体中可能混有O2,请用离子方程式解释__________,该同学为了验证O2,打开弹簧夹,用带火星的木条检验,该操作的错误为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温 25 ℃下,向一定量的 0.1 molL-1 的 MOH 溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用 pC 表示,pC=-lgc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是:
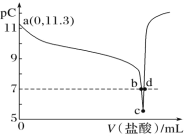
A.MOH 为弱碱,且 Kb 的数量级为![]()
B.随着稀盐酸的加入,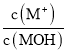 不断减小
不断减小
C.b 点溶液呈中性
D.c 点溶液中水的电离程度最大,且![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人类文明的历程中,改变世界的事物很多,其中铁、聚乙烯、二氧化硅、苯、青霉素、氨等17种“分子”改变过人类的世界。
(1)铁离子的价层电子排布图为_____________________。
(2)碳化硅晶体、硅晶体、金刚石均是原子晶体,用化学式表示其熔点由高到低的顺序是_________。
(3)1mol 苯分子中含有σ键的数目为_________。
(4)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子电负性由大到小的顺序是____________________。


(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图2所示,写出该产物的化学式______________________________。
(6)晶胞有两个基本要素:
①原子坐标参数:表示晶胞内部各微粒的相对位置。如图是CaF2的晶胞,其中原子坐标参数A处为(-![]() ,-
,-![]() ,0);B处为(0,0,0);则C处微粒的坐标参数为___________。
,0);B处为(0,0,0);则C处微粒的坐标参数为___________。

②晶胞参数:描述晶胞的大小和形状。晶胞参数a pm,求CaF2晶体的密度为______g·cm-3,(NA为阿伏加德罗常数的值,用含a、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。回答下列相关问题:

Ⅰ. SO2还原CuO探究
(1)装置A中发生反应的化学方程式_______________________________________。
(2)在制取SO2时,使用H2SO4溶液的浓度为__________时(填序号,从下列浓度中选取),制备SO2的速率明显快。请解释不选下列其它浓度硫酸的原因____________________。
a. 98% H2SO4 b.65% H2SO4 c. 5% H2SO4
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈现蓝色并仍有少量红色不溶物,由此可以得出:
①已知SO2与CuO反应生成两种产物,写出该化学方程式___________________________。
②取红色沉淀物滴加盐酸,反应的离子方程式______________________________________。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取m g固体溶解于水配制成100mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①若消耗0.1000mol/L Na2S2O3标准溶液VmL,则产物中CuSO4质量分数为____________。
②CuI沉淀物对I3—具有强的吸附能力,由此会造成CuSO4质量分数测定值_______(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温下,l mol C6H12中含碳碳键的数目一定小于6NA
B.18g果糖分子中含羟基数目为0.6NA
C.4.0g由H218O与D216O组成的混合物中所含中子数为2NA
D.50g质量分数为46%的乙醇溶液与足量的钠反应,放出H2的分子数目为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0× 10-18,其沉淀溶解平衡曲线如图所示(图中R表示Ni或Fe),下列说法正确的是(已知: ![]() ≈2.4,
≈2.4, ![]() ≈3.2) ( )
≈3.2) ( )

A. M点对应的溶液中,c(S2-)≈3.2×10-11 mol·L-1
B. 与P点相对应的NiS的分散系是均一稳定的
C. 向Q点对应的溶液中加水,可转化成N点对应的溶液
D. FeS+Ni2+![]() NiS+Fe2+的平衡常数K=6000
NiS+Fe2+的平衡常数K=6000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用白醋的有效成分为醋酸(CH3COOH),可使用酸碱中和滴定法进行测定。现用标准NaOH溶液测定市售“上海白醋”的总酸量(g/100mL)。请填写实验报告中的空白处。
(实验目的)测定市售“上海白醋”的总酸量
(实验用品)蒸馏水,上海白醋,0.1000mol/LNaOH标准溶液,酚酞;100mL容量瓶,___________,玻璃棒,滴定管,锥形瓶,烧杯,铁架台及附件。
(实验步骤)
(1)配制并移取待测食醋溶液:
①用___________(填仪器名称)量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得。
②取待测白醋溶液20.00 mL于锥形瓶中,并滴加2滴酚酞作指示剂。
(2)盛装标准NaOH溶液:滴定管经过洗涤后,装入NaOH标准溶液,使液面位于________________________________,记录滴定管的初读数。若液面位置如图所示,则此时的读数为____________mL。
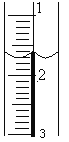
(3)滴定:当_____________________________________________时即为滴定终点。滴定到达终点后记录NaOH溶液的终点读数。再重复滴定3次。
(数据记录与处理)
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测食醋体积/mL | 20.00 | 20.00 | 20.00 | 20.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 15.95 | 16.20 | 15.15 | 16.20 |
(4)甲同学在处理数据时计算得:消耗NaOH溶液的平均体积(V)=![]() =15.76 mL,指出计算的不合理之处:____________________________________________,
=15.76 mL,指出计算的不合理之处:____________________________________________,
(5)按正确数据处理计算,“上海白醋”的总酸量=___________g/100mL。
(思考与讨论)
(6)查看瓶示:总酸≥5g/100mL(以醋酸计),则此次测量的相对误差至少为________。
(7)下列操作中可能造成该测量误差的是____________(填序号)。
a. 未用标准NaOH溶液润洗滴定管 b. 锥形瓶在滴定时剧烈摇动,有少量液体溅出
c. 滴定前未赶走滴定管尖嘴中的气泡 d. 锥形瓶中加入待测白醋溶液后,再加少量水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com