
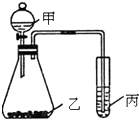
 按要求完成下列各题:
按要求完成下列各题: .H2O的电子式为
.H2O的电子式为 .
.分析 (1)MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到;水是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况;
(2)先计算H2O和D2O的物质的量,再计算分子中质子数之比;
(3)①通过复分解反应可以比较物质酸性强弱,最高价氧化物酸性越强,元素非金属性越强;
②单质的氧化性越强,元素的非金属性越强.
解答 解:(1)MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到,用电子式表示形成过程为: ,
,
H2O是共价化合物,是由原子和氢原子形成共价键,电子式为 ,
,
故答案为: ;
; ;
;
(2)质量相同的H2O和D2O的物质的量之比为$\frac{1}{18}$:$\frac{1}{20}$=10:9,所以质子数之比为10:9,
故答案为:10:9;
(3)①元素非金属性强其最高价氧化物对应的水合物酸性越强,即酸性硫酸>碳酸>硅酸,根据强酸制取弱酸的原理知甲、乙、丙,
故答案为:硫酸、碳酸钠、硅酸钠;
②水与过氧化钠反应生成氧气,氧气氧化性比硫强,氧气通入硫化氢溶液中可将硫置换出来,则非金属性:O>S.
故答案为:O>S.
点评 本题考查电子式的书写、物质组成微粒的计算及元素非金属性强弱的判断,题目难度中等.书写电子式要分清物质类别,计算微粒时先计算物质的物质的量,这样可以有效避免出错.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和O2组成的混合物中共有NA个分子,其中氧原子数为2NA | |
| B. | 78g过氧化钠与足量的CO2和H2O(g)混合气体充分反应,转移的电子数一定为NA | |
| C. | 1 mol 氢氧根和1 mol 羟基中含有的质子数均为 9 NA | |
| D. | 标准状况下,2.24L氯仿(CHCl3)中含有C-Cl数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na>S>O | B. | 酸性:H3PO4>H2SO4>HClO4 | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 元素金属性:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、③金刚石、④氨水、⑤CH3CH2CH2CH3、⑥${\;}_{17}^{37}$Cl、⑦${\;}_{17}^{35}$Cl、⑧C70、⑨氨气.
、③金刚石、④氨水、⑤CH3CH2CH2CH3、⑥${\;}_{17}^{37}$Cl、⑦${\;}_{17}^{35}$Cl、⑧C70、⑨氨气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一元素不可能既有金属性,又有非金属性 | |
| B. | 某粒子${\;}_{z}^{A}$Rn+的核外电子数为Z+n | |
| C. | 41Ca与40Ca的失电子能力相同 | |
| D. | Cl?、S2?、Ca2+、K+半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌作电极与硫酸铜溶液构成的原电池中铜作负极 | |
| C. | 电子由外导线从锌流向铜,进入硫酸溶液后被H+得到而释放出H2 | |
| D. | 铜锌原电池工作时,若电路中通过0.4 mole-,锌片质量将减少13g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,某溶液中由水电离出的c(H+)=10-5 mol•L-1,则此溶液可能是盐酸 | |
| B. | pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,NH4+大小顺序为:①>②>③ | |
| C. | 0.2 mol•L-1 CH3COOH溶液与0.1 mol•L-1 NaOH溶液等体积混合: c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | 0.1 mol•L-1 NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)>c(HCO3-)+c(CO32-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com