
| 编号 | a的取值范围 | 产物的化学式(或离子符号) |
| A | a≤1/6 | I2 Br- H2O |
| B | 1/6<a<1/5 | |
| C | a=1/5 | I2 Br2 H2O |
| D | 1/5<a<6/5 | I2 IO3- Br2 H2O |
| E | a≥6/5 |
| 3 |
| 5 |
| 3 |
| 5 |


科目:高中化学 来源: 题型:
| A、1 mol/(L?min) |
| B、2mol/(L?min) |
| C、4 mol/(L?min) |
| D、8mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
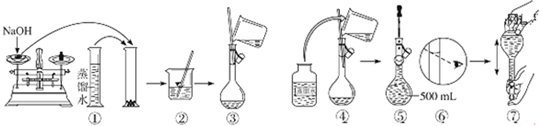
查看答案和解析>>
科目:高中化学 来源: 题型:
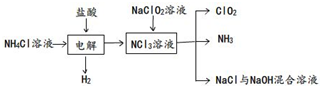
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
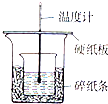 实验室利用如图装置进行中和热的测定,请回答下列问题:
实验室利用如图装置进行中和热的测定,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com