
【题目】下列实验过程中产生的现象与对应的图形符合的是
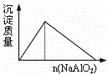
A.盐酸溶液中加入NaAlO2

B.SO2气体通入溴水中
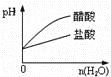
C.pH=2的醋酸与盐酸溶液分别加水稀释
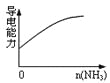
D.氨气通入醋酸溶液中
【答案】BD
【解析】
A.向盐酸中加入NaAlO2,开始时,盐酸过量,AO2-与H+生成的Al(OH)3会继续溶解,离子方程式为AlO2-+4H+=Al3++2H2O;当盐酸完全消耗完,Al3+和AlO2-双水解,生成白色沉淀,离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,所以开始没有沉淀,加入一定量之后才会有沉淀生成,A项错误;
B.SO2具有还原性,Br2具有氧化性,二者发生反应,离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-,生成了酸,酸性增强,pH减小,B项正确;
C.醋酸是弱酸,加入稀释,促进醋酸电离,其pH的变化小于HCl,盐酸溶液pH的变化曲线应该在上面,C项错误;
D.氨水中的一水合氨会与醋酸反应,离子方程式为NH3·H2O+CH3COOH=CH3COO-+NH4++H2O,溶质由弱电解质变成强电解质,离子浓度增加,导电能力增强,D项正确;
综上答案为BD。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量 (g/100mL )。
I.实验步骤:
(1)用_____ (填仪器名称 )量取10.00mL 食用白醋,在_____ (填仪器名称 )中用水稀释后转移到100mL_____ (填仪器名称 )中定容,摇匀即得待测白醋溶液。
(2)用_____色手柄滴定管取待测白醋溶液 20.00mL 于锥形瓶中,向其中滴加2滴_____作为指示剂。
(3)读取盛装0.1000mol/L NaOH 溶液的滴定管的初始读数。如果液面位置如图所示 则此时的读数为_____mL。
![]()
(4)滴定。当_____时,停止滴定,并记录 NaOH溶液的终读数,重复滴定 3 次。
II.实验记录
滴定次数 实验数据 (mL ) | 1 | 2 | 3 | 4 |
V (样品 ) | 20.00 | 20.00 | 20.00 | 20.00 |
V (NaOH ) (消耗 ) | 15.95 | 15.00 | 15.05 | 14.95 |
(5)甲同学在处理数据时计算得平均消耗的NaOH溶液的体积为:V= (15.95+15.00+15.05+14.95 )/4=15.24(mL)。指出他的计算的不合理之处:_____。 按正确数据处理,可得c (市售白醋)=_____mol/L。
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是_____ (填写序号)
a.盛装NaOH的滴定管在滴定时未用标准NaOH溶液润洗
b.盛装待测白醋的滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铁屑(主要成分为Fe,还含有C,S,P等)制取高效净水剂K2FeO4流程如图:

下列说法不正确的是
A. 废铁屑在酸溶前可用热的纯碱溶液去油污
B. 步骤②是将Fe2+转化为Fe(OH)3
C. 步骤③中发生的反应的离子方程式为2Fe(OH)3+3ClO-==2FeO42-+3Cl-+4H++H2O
D. 步骤④中反应能发生的原因是在相同条件下,K2FeO4的溶解度小于Na2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一稀酸对Fe﹣Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )

A.稀硝酸对Fe﹣Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:Fe+6HNO3(稀)═Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe﹣Cr合金的腐蚀性最强
D.随着Cr含量增加,稀硝酸对Fe﹣Cr合金的腐蚀性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组实验探究KI和FeCl3生成KCl、I2和FeCl2的反应存在一定限度。
实验:i.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCl3溶液。充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
(1)将KI和FeCl3反应的离子方程式补充完整。_____I-+___Fe3+![]() ______I2+_______Fe2+
______I2+_______Fe2+
(2)步骤ⅲ中,试剂X是_____________。
(3)步骤ⅱ和ⅲ的实验现象中,能说明①中反应存在一定限度的实验现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种锂盐的结构如图,它是一种新型锂离子电池的电解质,其阴离子由W、X、Y、Z四种同周期主族元素构成,Y原子的最外层电子数是X的次外层电子数的3倍(箭头指向表示共用电子对由W提供)。下列说法错误的是( )

A.元素非金属性强弱顺序是W>Y>Z>X
B.阴离子中X与Z的杂化方式相同
C.原子半径X>Z>Y>W
D.该物质中含有极性键、非极性键、配位键和离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g)![]() 2C(g)达到平衡状态标志的是( )
2C(g)达到平衡状态标志的是( )
①C生成的速率与C分解的速率相等;②单位时间内生成a mol A,同时生成3a mol B;③A、B、C的浓度不再变化;④A、B、C的压强不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦单位时间内消耗a mol A,同时生成3a mol B;⑧A、B、C的分子数之比为1∶3∶2
A.②⑧B.①⑥C.②④D.③⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入6molL﹣1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mLB.45 mLC.30 mLD.50 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com