
【题目】下列物质中既含有离子键又含有共价键的是
A.NaOHB.HCl
C.CaCl2D.H2O2
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】按图装置实验,若x轴表示流入正极的电子的物质的量,则y轴应表示( )
①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的质量
A. ① ③ B. ③ ④ C. ① ② ④ D. ②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学学习中非常重要的内容,根据下面两个实验回答问题。
(一)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀。
(1)分别向两支试管中加入不同试剂,记录实验现象如表:(表中填空填下列选项中字母代号)
试管编号 | 加入试剂 | 实验现象 |
Ⅰ | 2滴0.1mol/LFeCl3溶液 | ①_____ |
Ⅱ | 4mL2mol/LNH4Cl溶液 | ②_____ |
A.白色沉淀转化为红褐色沉淀 B.白色沉淀不发生改变
C.红褐色沉淀转化为白色沉淀 D.白色沉淀溶解,得无色溶液
(2)同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动。
猜想2:____________________________________________________________。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明猜想正确的是____(填 “1”或“2”)。
(二)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.000 0 g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI===3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250 mL,然后取25.00 mL用5.0×10-4 mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O32-===2I-+S4O62-)。有关实验数值如下表所示。
滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
第一次 | 25.00 | 0.00 | 15.90 |
第二次 | 25.00 | 0.00 | 14.99 |
第三次 | 25.00 | 0.00 | 15.01 |
该碘盐中碘元素的百分含量为________。(保留三位有效数字)下列操作中,会导致所测得的碘元素的百分含量偏大的是________。
a.滴定终时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)实验室制取氯气的化学方程式为4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O,MnO2做______剂,如果反应产生的气体在标况下体积为2.24L,则被氧化的HCl的物质的量是_____mol
Cl2↑+MnCl2+2H2O,MnO2做______剂,如果反应产生的气体在标况下体积为2.24L,则被氧化的HCl的物质的量是_____mol
(2)写出下列反应的离子方程式:
①金属A和水__________________________________________。
②物质B和气体乙_______________________________________。
(3)用两个化学方程式表示固体G可做呼吸系统供氧剂原因_______________________。
(4)用化学方程式解释F长期放置在空气中失效的原因___________________________。
(5)红热细铁丝能在气体乙剧烈燃烧,现象是____________________,将燃烧产物配成饱和溶液滴入沸水中可以得到的氢氧化铁胶体,该氢氧化铁胶体粒子直径在_________之间。向氢氧化铁胶体中滴入过量稀硫酸,现象是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 在标准状况下,11.2 L NO 与11.2 LO2混合后所含原子数为NA
B. 110 g Na2S2中含有的离子数为3NA
C. 0.1mol·L-1Na2CO3溶液1L所含阴离子数目小于0.1NA
D. 1mol Cl2溶于足量的水中,反应时断裂的Cl-Cl 键数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将 2 mol 气体A 与 1 mol 气体B 充入一个体积不变的容器内,发生反应:2A+B C+3D+4E,达到平衡后气体A 的浓度减少一半,发现有液体生成,在相同的温度下测得反应 前后压强分别为 6.06×106 Pa 和 8.08×106 Pa,又测得反应共放出热量 Q kJ,下列说法正确的是( )
A. 该反应在任何温度下都可自发进行
B. 在上述平衡体系中再加入 1 mol A 和 0.5 mol B,平衡正向移动,A 的转化率增大
C. 该反应的热化学方程式为 2A(g)+B(g) C(g)+3D(l)+4E(g) ΔH= -Q kJ/mol
D. 上述反应达到平衡后,其他的条件不变的情况下,升高温度,压强一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式正确的是( )
A. NaHSO4 = Na++ HSO4-B. BaSO4 = Ba2++SO42-
C. CH3COONH4![]() NH4+ + CH3COO-D. H2CO3
NH4+ + CH3COO-D. H2CO3![]() 2H++CO32-
2H++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 含离子键的化合物一定是离子化合物B. 非金属元素只能形成共价化合物
C. 含共价键的化合物一定是共价化合物D. 非极性键只存在于非金属单质中
查看答案和解析>>
科目:高中化学 来源: 题型:
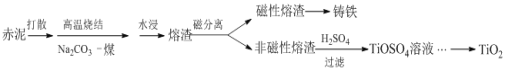
【题目】赤泥是铝土矿提取氧化铝过程中产生的固体废弃物,其主要成分为Fe2O3、Al2O3、CaO、TiO2、SiO2等,属于强碱性废渣。从赤泥中回收钛的工艺流程如下:
请回答以下问题:
(1)赤泥颗粒孔隙大,具有较大的比表面积,可作为废气SO2的吸收剂,研究表明该过程中主要利用了化学中和反应,其次是______。
(2)赤泥加一定量水打散的目的是______。
(3)已知高温烧结时,TiO2发生的反应是Na2CO3+TiO2 ![]() Na2TiO3+CO2↑,且Na2TiO3不溶于水。则Al2O3在烧结中发生的反应是______,水浸液里的主要溶质有______。
Na2TiO3+CO2↑,且Na2TiO3不溶于水。则Al2O3在烧结中发生的反应是______,水浸液里的主要溶质有______。
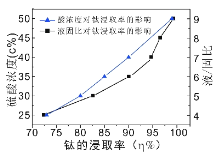
(4)酸浸时,若使钛的浸出率(η%)达到90%,则根据右图工业上应采取的适宜条件是:酸浓度和液固比的取值分别约为______、______。同时浸出温度过高可能造成的环境污染是__________。
(5)TiO2在一定条件下可转化为TiCl4而获得精制提纯,控制TiCl4水解的条件还可以制得TiO2·xH2O纳米材料,该水解过程的化学方程式是______。
(6)赤泥中含钛(以TiO2的质量分数表示)一般为4% ~12%,假设在上述工艺中钛的总回收率为75%,则1t赤泥获得TiO2的最大质量为______kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com