
下列解释事实或实验现象的化学用语正确的是
A.向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O 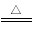 Fe(OH)3↓+ 3H+
Fe(OH)3↓+ 3H+
B.酸性KI淀粉溶液久置后变蓝4I-+O2+2H2O=2I2+4OH-
C.实验室盛装NaOH溶液的试剂瓶不能用玻璃塞 SiO2 +2OH- = SiO32-+H2O
D.钢铁表面的水膜酸性较强时,水膜中的H+会被还原O2+4H++4e- = 2H2O
科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:填空题
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+ ,由此说明:
,由此说明:
(1)H2O2的氧化性比Fe3+ ,其还原性比Fe2+ (填“强”或“弱”)
 (2)
(2) 在H2O2分解过程中,FeSO4溶液 的作用是
在H2O2分解过程中,FeSO4溶液 的作用是
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.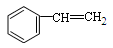 没有顺反异构体
没有顺反异构体
B.1,3-丁二烯可以作为合成高分子化合物的原料
C.用乙醇和浓硫酸制备乙烯时,用水浴加热控制反应温度
D.常温下,将苯酚加入到少量水中有浑浊,滴入适量NaOH溶液后浑浊消失
查看答案和解析>>
科目:高中化学 来源:2015届北京市东城区普通校高三11月联考化学试卷(解析版) 题型:选择题
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C =2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:填空题
(本小题14分)现有A、B、C、D四种短周期主族元素,其原子序数依次增大。已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。请回答下列问题:
(1)元素D在周期表中的位置是________________________。
(2)C2B2所含的化学键类型有___________;请写出C2B2与A2B反应的离子方程式________________。
(3)元素B、C形成的简单离子中半径较大的是_________(写电子式)。
(4)仅由C、D两种元素组成的一种盐溶于水后pH>7的原因是_____________ (用离子方程式表示)。
(5)如图所示以铂作电极,以C、D两元素的最高价氧化物的水化物X、Y的溶液作为电解质溶液,A、B元素的单质分别在两电极上发生原电池反应,则通入B单质的电极反应式为_________,通入A单质的X溶液的pH将__________(填“增大”、“不变”或“减小”)。
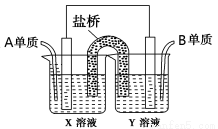
查看答案和解析>>
科目:高中化学 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:选择题
若NA表示阿伏加德罗常数,下列说法正确的是
A.标准状况下,6.72LNO2与水充分反应转移电子数为0.1NA
B.18gD2O中含有的质子数目为10NA
C.常温常压下,1mol氦气中含有的核外电子数为2NA
D.ag某气体含分子数为b,cg该气体在标况下的体积为22.4ab/(c NA) L。
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市高三上学期9月质量检测化学试卷(解析版) 题型:填空题
(15分)(化学与技术)某硫酸厂以含有SO2的尾气、氨气等为原料,合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
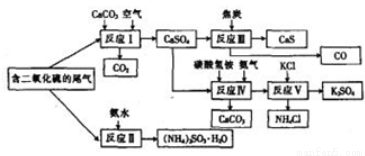
(1)写出反应Ⅲ的化学方程式: 。
(2)下列有关说法正确的是 (填字母)
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅱ和反应Ⅲ的基本反应类型相同
C.反应Ⅳ需控制在60---70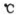 ,目的之一是减少碳酸氢铵的分解
,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
(3)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式: 。
(4)很多硫酸厂为回收利用SO2,直接用氨水吸收法处理尾气。
① 用15.0 mL 2.0 mol/L氨水吸收标准状况下448 mL SO2,吸收液中的溶质为
。
② 某同学用酸性KMnO4溶液滴定上述吸收液,当达到滴定终点时,消耗KMnO4溶液25.00 mL,则酸性KMnO4,溶液中c(KMnO4) = 。
(5)氨气用途广泛,可以直接用于燃料电池,下图是用氨水作原料的燃料电池的工作原理。

氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液,氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池总反应的化学方程式是 ,负极的电极反应式是
。
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市高三上学期9月质量检测化学试卷(解析版) 题型:选择题
橄榄石型LiFePO4是一种锂离子电池正极材料,下列有关LiFePO4 的说法中不正确的是
A.LiFePO4中铁元素的化合价为+2价 B. LiFePO4 中Li、P、O均属于短周期元素
C.LiFePO4能与稀硫酸发生氧化还原反应 D.LiFePO4中Li、Fe、P均属于主族元素
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古巴彦淖尔市高三10月月考化学试卷(解析版) 题型:选择题
在恒容密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)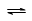
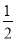 N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.温度不变同时充入Ar
D.降低温度同时增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com