
化工生产盐酸的主要过程是:

(1)其中关键的一步为如图所示的氯气和氢气在燃管口燃烧,生成HCl.氯气有毒,为此通入气体的合理方式是:A处通入________,B处通入________;同时应采取的措施是________.

(2)合成盐酸厂要求合成气中的HCl的体积分数要大于97%,试用最简便的方法进行分析________.
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2009年安徽省合肥一中高考化学冲刺最后一卷(解析版) 题型:填空题
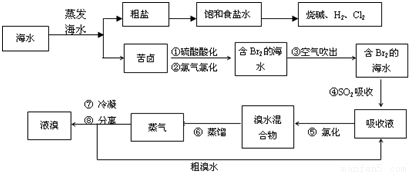
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com