
(2分)写出反应的离子方程式:向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,
在以上中性溶液中,继续滴加Ba(OH)2溶液,写出反应的离子方程式:
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
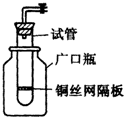 (1)某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体
(1)某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体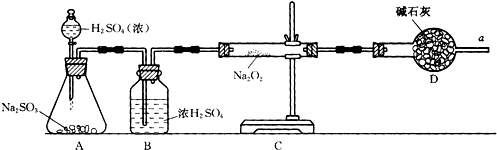
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |


查看答案和解析>>
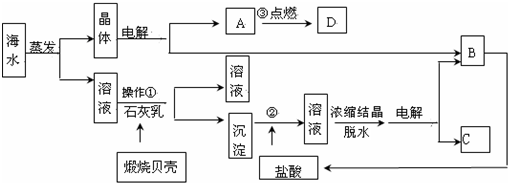
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
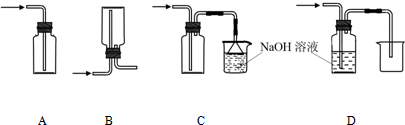
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com